

增强富锂反钙钛矿的水分稳定性实现可持续的全固态锂电池
锂电池
描述
01
导读
全固态锂电池(ASSLB)由于其高安全性和高能量密度而引起了人们的广泛关注。目前对ASSLB的研究不仅关注提高电化学性能,还关注降低其制造成本。而富锂反钙钛矿(LiRAP)固态电解质由于其结构可调性、机械灵活性和低成本等优点而引起了研究人员广泛的兴趣。然而,LiRAP具有本能的吸湿性,并且在空气中容易分解,这不仅影响了其电化学性能,同时也阻碍了它们在全固态锂电池(ASSLB)中的应用。大量关于水分对LiRAP电化学性能影响的研究已经被报道,然而,吸湿性的机制仍然不是很清楚。如果能明晰其机制,将对LiRAP的改性提供指导,从而进一步推动ASSLB的发展
02
成果简介
目前对LiRAP的研究主要集中在相稳定性和锂离子传输机制上,而其低熔点和高延展性等显著优点却被忽视了。LiRAP能够提供相对较高的离子电导率,以减少ACLB的极化和低得多的烧结温度。此外,相对较小的弹性模量也使得LiRAP作为ACLB的烧结助剂在充放电过程中释放过渡金属氧化物正极材料的应力具有竞争力。然而,LiRAP的这种有前景的应用也因其吸湿性和空气中的不稳定性而受到极大阻碍。因此,应开发防潮LiRAP以促进LiRAP在ASSLB中的实际应用。
复旦大学王飞、夏永姚团队系统地研究了LiRAP的吸湿性,以揭示其多样化的电化学性能,如离子/电子电导率和离子转移数。为了提高LiRAP的阻湿性,并促进其在空气中的应用,引入氟(F)以加强分子内氢键,同时削弱LiRAP与水分H2O之间的分子间氢键。所制备的Li3-x(OHx)Cl0.9F0.1使LiRAP在空气下的ASSLB制造中得到实际应用。此外,利用Li3-x(OHx)Cl0.9F0.1(274℃)的低熔点,通过共包覆烧结和熔渗在空气中组装了两个全陶瓷锂电池(ACLB),这表明LiRAP在ASSLB行业中最实际的应用是作为烧结助剂。
03 关键创新
(1)系统地研究了吸湿性的起源以及吸湿性对Li3-x(OHx)Cl电化学性能的影响;
(2)通过在氯位点掺杂氟,LiRAP的吸湿性通过削弱LiRAP与H2O之间的分子间氢键而被抑制,形成防潮的Li3-x(OHx)Cl0.9F0.1;
(3)利用其低熔点,通过共包覆烧结和熔渗在空气中组装了两个ASSLB。使用LiRAP作为粘结剂,低温烧结具有低界面电阻的ASSLB被证明是可行的。
04
核心内容解读
为了研究吸湿性对离子电导率的影响,将Li3-x(OHx)Cl暴露在空气中,持续时间从1分钟到60分钟不等。如奈奎斯特图所示,原始Li3-x(OHx)Cl(未暴露在空气中)显示出低离子电导率。然而,仅暴露1分钟,离子电导率就突然飙升。体积电导率和晶界电导率显著增加,总电导率比原始电导率高一个数量级以上。随着暴露时间的延长,总离子电导率进一步增加,表明暴露于水分增加了Li3-x(OHx)Cl的离子电导率。当温度高于60℃时,暴露30和60分钟的Li3-x(OHx)Cl表现出非Arrhenius行为,当温度升高时离子电导率甚至降低。这种现象可归因于吸收的H2O在较高温度下的蒸发,这也证实了LiRAP的高吸湿性。
如果没有在Li位点掺杂任何阳离子或在氯位点掺杂阴离子,则缺乏Li空位,现有的Li空位只能有序地使每个氧化物离子由4个锂离子和2个氢离子阳离子配位(图1e)。因此,即使在较高温度下,原始LiRAP的离子电导率通常也很低。图1f中的示意图说明了锂离子导电机制在原始和水分污染的Li3-x(OHx)Cl中的时间演变。
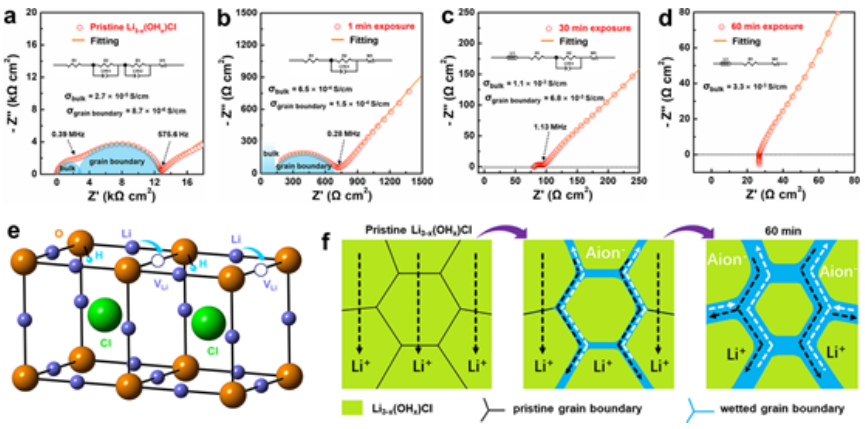
【图1】 吸湿性对离子电导率的影响。具有不同暴露持续时间的Li3-x(OHx)Cl的EIS图,(a)原始,(b)1分钟,(c)30分钟,(d)60分钟。(e)Li3-x(OHx)Cl的晶体结构。(f)Li3-x(OHx)Cl中锂离子导电机制的时间演化。
计时电流法被用于研究LiRAP在空气暴露过程中电子电导率的演变。如直流极化曲线(图2b)所示,随着暴露时间的延长,Li3-x(OHx)Cl的电子电导率显著增加。图2c中的曲线说明了离子电导率和电子电导率随暴露持续时间的趋势,在前10分钟内急剧增加,然后减慢。最后,离子和电子电导率比原始Li3-x(OHx)Cl高2和4个数量级,甚至接近“饱和Li3-x(OHx)Cl”水溶液的离子和电子电导率。
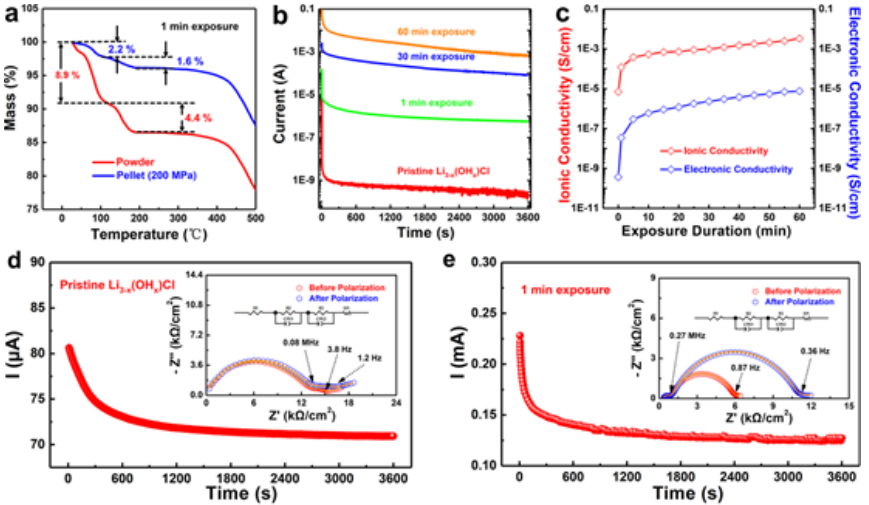
【图2】水分对电子电导率和离子转移数的影响。(a)暴露1分钟的Li3-x(OHx)Cl粉末和颗粒的TG曲线。(b)不同暴露时间的Li3-x(OHx)Cl的直流极化曲线。(c)Li3-x(OHx)Cl的离子和电子电导率的时间演变。(d)原始和(e)1分钟暴露的LiRAP颗粒的锂离子迁移数。
采用X射线光电子能谱(XPS)和X射线衍射(XRD)来了解LiRAP在暴露期间的副反应。如图3a的XPS光谱所示,532.7 eV处的O-Cl键表明形成了LiRAP。Li3-x(OHx)Cl短时间暴露在空气中后,明显的O-C峰可归因于Li2CO3的形成,表明Li3-x(OHx)Cl立即被CO2污染。
此外,在531.0 eV处还存在一个强的O-H峰,这不仅可以归因于LiRAP中残留的O-H键,还可以归因于吸收的H2O。当Li3-x(OHx)Cl进一步暴露在空气中1分钟时,O-C峰加强,主峰左移约0.6 eV,表明副产物Li2CO3变多。相应地,图3b中的XRD图进一步表明,Li3-x(OHx)Cl在空气中不稳定。
傅立叶变换红外光谱(FTIR)和拉曼光谱也用于研究吸湿性的动态演变。如图3c所示,当暴露在空气中时,Li3-x(OHx)Cl的非原位FTIR光谱显示,ν(H-O)和δ(H-O)峰在3400和1500 cm-1附近显著增加。仅暴露1分钟后,δ(H-O)峰就显示出明显的分裂,表明形成了结晶水。图3d中的原位FTIR光谱证明了暴露持续时间、吸收的H2O的质量增加以及H-O键的强度之间的关系。图3e中的拉曼位移也证明了LiRAP的强吸湿性。检测到的分子间氢键可以归因于LiRAP吸湿性的起源。
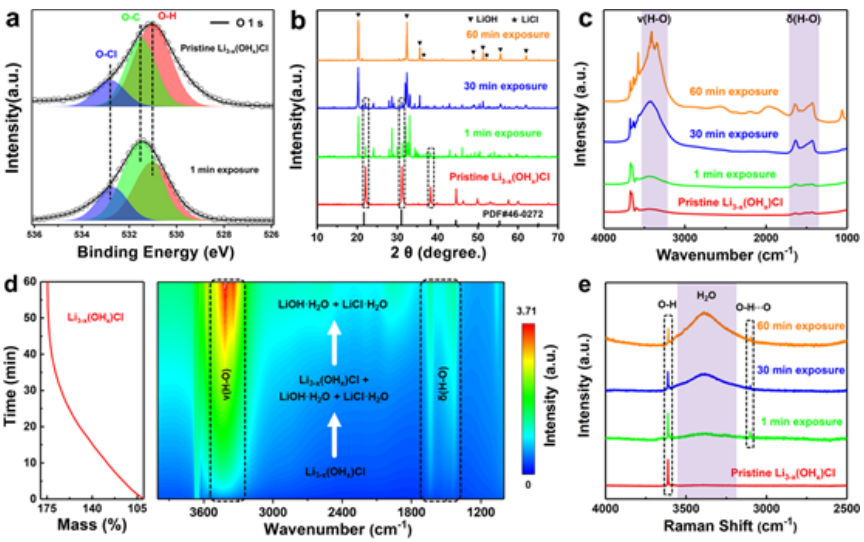
【图3】水分对相稳定性的影响。(a)原始和1分钟暴露的Li3-x(OHx)Cl的XPS光谱。(b)XRD图和(c)具有不同暴露时间的Li3-x(OHx)Cl的非原位FTIR光谱。(d)Li3-x(OHx)Cl的质量增加和原位FTIR光谱。(e)不同暴露时间的Li3-x(OHx)Cl的拉曼位移。
为了抑制LiRAP的吸湿性,提出了在氯位点掺杂氟的策略。根据图4a中的XRD图,氟的最大掺杂量为每个晶格0.1摩尔。根据先前的研究,F掺杂将Li3-x(OHx)Cl的室温结构从斜方晶系或四方晶系转变为立方晶系。
图4b中的XRD精修显示,Li2.8(OH0.2)Cl0.9F0.1具有0.1摩尔氟掺杂和0.2摩尔锂耗尽(每个晶格)处于立方相。Li耗尽的变化对相变几乎没有影响,因为0.2摩尔的耗尽量非常小。因此,氟掺杂使立方相在室温下更稳定。在正交相或四方相中,氢旋转被冻结,固定的OH物质由于强静电相互作用而阻塞锂离子传输通道。但在立方相中,随着卤素位点半径的减小,氢旋转更自由,这增加了锂离子可及位置的数量,从而提高了离子电导率。
为了研究吸湿性抑制的效果,如图4c所示,Li3-x(OHx)Cl0.9F0.1的TG曲线显示含水量比Li3-x(OHx)Cl小得多。由于从正交或四方结构转变为立方结构,原始Li3-x(OHx)Cl0.9F0.1的室温离子电导率增加。为了研究吸湿性对F掺杂离子电导率的影响,Li3-x(OHx)Cl0.9F0.1也暴露在空气中1、30、60分钟。发现离子电导率小于Li3-x(OHx)Cl(图4d),表明Li3-x(OHx)Cl0.9F0.1中的副反应得到了缓解。为了研究对副反应的抑制,暴露于空气中的Li3-x(OHx)Cl0.9F0.1也进行了脱水处理。如图4e中得出的结论,受污染的水分和脱水的Li3-x(OHx)Cl0.9F0.1的离子电导率差距远小于Li3-x(OHx)Cl。
为了进一步了解Li3-x(OHx)Cl0.9F0.1中抑制吸湿性的机制,进行了固态核磁共振(SSNMR)来研究非掺杂和氟掺杂LiRAP中的分子内氢键。原始Li3-x(OHx)Cl和Li3-x(OHx)Cl0.9F0.1在未暴露于空气的情况下进行表征,因此图4f中的1H SSMAS光谱强度反映了分子内氢键的强度。Li3-x(OHx)Cl0.9F0.1的强度比Li3-x(OHx)Cl高表明分子内氢键强得多,这是由于氟的电负性比氯强。此外,氟掺杂还导致LiRAP的晶格畸变,这可能在氧和卤素之间形成更合适的长度,这与O-H···X(X=Cl或F)的长度一致。
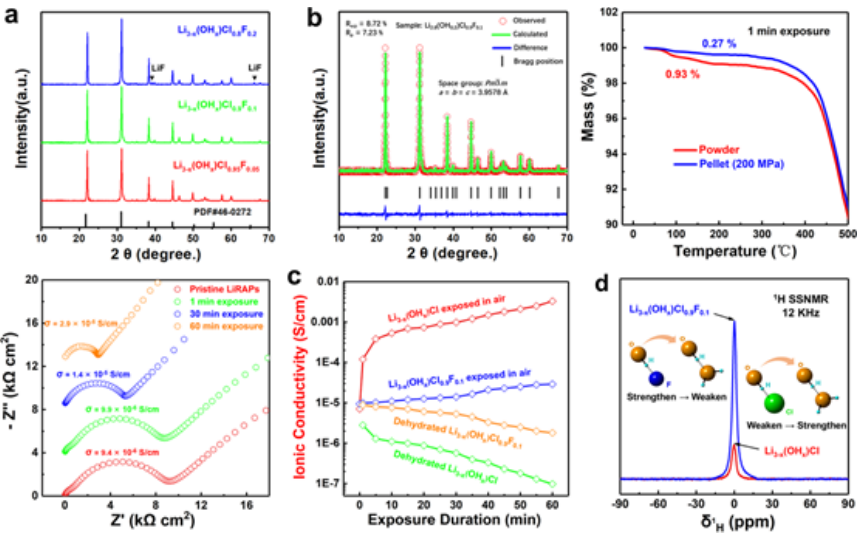
【图4】掺氟LiRAP Li3-x(OHx)Cl0.9F0.1的结构和吸湿性。(a)氟掺杂LiRAP的XRD图。(b)Li2.8(OH0.2)Cl0.9F0.1的Rietveld精修图。(c)暴露1分钟的Li3-x(OHx)Cl0.9F0.1粉末和颗粒的TG曲线。(d)具有不同暴露时间的Li3-x(OHx)Cl0.9F0.1的EIS图谱。(e)暴露在空气中并脱水的Li3-x(OHx)Cl和Li3-x(OHx)Cl0.9F0.1的离子电导率随时间的变化。(f)Li3-x(OHx)Cl和Li3-x(OHx)Cl0.9F0.1的1H SSNMR光谱。
抑制LiRAP的吸湿性将改善其在ASSLB制造中的实际应用,尤其是空气中的电池组装过程。通过集成LiRAP作为烧结助剂来粘结活性正极材料(LiFePO4、LFP)、电子导体(Super-P、SP)和石榴石型固态电解质(Li6.75La3Zr1.75Ta0.25O12,LLZTO)。图5a中的示意图说明了共包覆烧结的组装过程。通过球磨将Li3-x(OHx)Cl0.9F0.1涂覆在LFP和LLZTO上,并在仅290℃的温度下热压制备全陶瓷基正极和复合电解质。最后,将金属锂负极连接在底部,从而组装出ACLB,即type1。
如图5b所示,准备好的ACLB的阻抗包含四个部分:(1)体相(2)复合电解质的晶界电阻(3)正极和(4)负极界面电阻。如图5c所示的初始充放电曲线,ACLB-type1中LFP在0.05 C和90℃下的比容量为83.6 mAh/g。初始充/放电期间的库仑效率为89.3%,随后增加至约99%(图5d),可能是由于逐渐稳定的界面接触。相应地,ACLB在前3个循环中表现出相对较快的容量衰减,但衰减逐渐减慢,50个循环后容量保持率为70.1%。
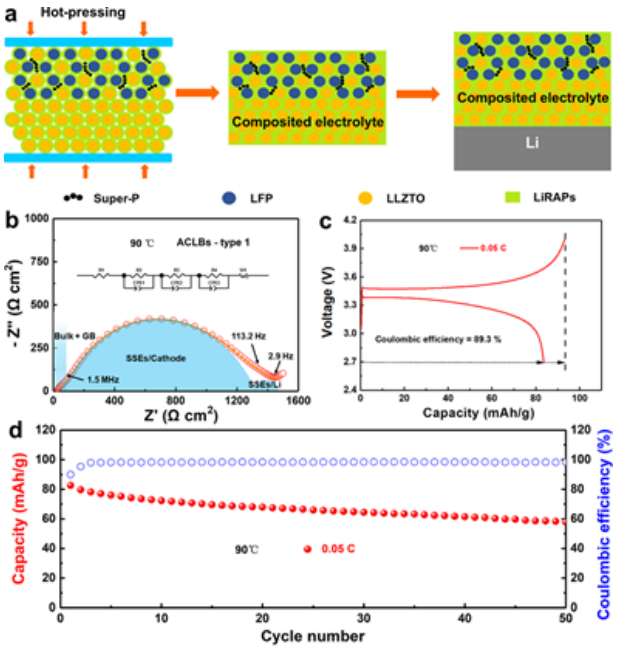
【图5】使用LiRAP作为共包覆烧结助剂的ACLB的电化学性能。(a)电池组装示意图。(b)EIS曲线,(c)初始充/放电曲线,和(d)第一种ACLB的循环。
除了共包覆烧结外,还通过熔渗组装了另一种ACLB,即ACLB-type2。如图6a所示,Li3-x(OHx)Cl0.9F0.1首先在290℃下熔化,倒在LFP、SP和LLZTO的混合物上,然后渗透到空隙中。过量的未渗透的Li3-x(OHx)Cl0.9F0.1充当固态膜。最后,将全陶瓷正极和电解质与金属锂负极连接。
如图6b所示的ACLB-type2的EIS曲线,Li3-x(OHx)Cl0.9F0.1的体相电阻仅占电池总阻抗的一小部分,而正极/Li3-x(OHx)Cl0.9F0.1界面显示出更大的ASR。ACLB-type2的巨大阻抗可能是由于较厚的正极层,它比ACLB-type1的正极厚约两倍。因此,ACLB-type2的比容量相对较小,在0.05 C为70.8 mAh/g(图6c)和50个循环后较小的容量保持率为62.5%(图6d)。
尽管ACLB-type1具有优异的电化学性能,但ACLB-type2具有简化堆叠过程和降低固态电解质质量比的优点,更适合应用于ASSLB。未来的工作应侧重于降低复合正极的阻抗,以实现具有更小极化和更长循环寿命的ASSLB。
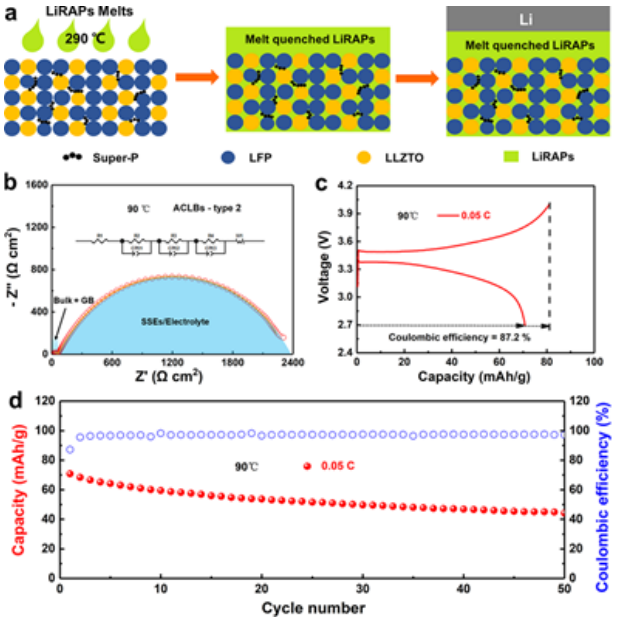
【图6】ACLB通过熔渗的电化学性能。(a)电池组装示意图。(b)EIS曲线,(c)初始充/放电曲线,和(d)第二种ACLB的循环。
05
成果启示
这项工作系统地研究了吸湿性对LiRAP的电化学性能和相稳定性的影响。通过在氯位点掺杂氟强化分子内氢键,削弱了Li3-x(OHx)Cl0.9F0.1与H2O的分子间氢键,成功抑制了吸湿性。274℃的低熔点也使得Li3-x(OHx)Cl0.9F0.1作为烧结助剂能够通过共包覆烧结和熔渗两种方法制备ACLB,经过50个循环后,其容量保持率分别为70.1%和62.5%。通过对吸湿性的研究,提出了一种防潮的Li3-x(OHx)Cl0.9F0.1,并将Li3-x(OHx)Cl0.9F0.1作为电解质在ACLB中进行了实际应用,这将提供新的开发低成本ASSLB的可持续制造战略。
审核编辑:刘清
-
钙钛矿太阳能电池稳定性及发展前景2018-03-01 14469
-
梯度导锂层可大幅提升锂电池循环稳定性2020-04-14 1750
-
干货:全固态锂电池的分类和应用2020-07-27 5728
-
构筑高效且稳定的埋底异质结助力钙钛矿电池光稳定性2022-12-02 946
-
基于大数据将统计学方法在钙钛矿稳定性评估上的应用2022-12-23 1006
-
基于大数据的钙钛矿太阳能电池稳定性分析方法2023-01-12 1588
-
反型结构钙钛矿太阳能电池取得新突破2023-11-24 728
-
钙钛矿叠层电池知识整理汇总2023-11-30 1850
-
影响钙钛矿太阳能电池稳定性的因素2024-04-24 1227
-
钙钛矿太阳能电池稳定性要求所涉及的必要测试环节2024-04-24 1564
-
钙钛矿太阳能电池的湿热稳定性与效率优化2024-04-30 791
-
钙钛矿/晶硅叠层太阳能电池稳定性测试2024-07-25 1285
-
钙钛矿太阳能电池稳定性测试的最大功率点跟踪(MPPT)2024-10-10 997
-
北大Nature:高米勒指数晶面相干生长增强的钙钛矿太阳能电池2024-11-08 363
-
接触角测量揭示TTC疏水层对钙钛矿太阳能电池稳定性的影响2024-11-27 355
全部0条评论

快来发表一下你的评论吧 !

