

热失控下锂电池内部化学反应研究
电源/新能源
描述
通常,锂电池的热失控是受到3种滥用的影响而引起的,分别是机械滥用、电滥用、热滥用。 其中,机械滥用指电池受到碰撞、挤压、针刺等外部受力,电滥用指电池受到内部、外部短路,过充、放电; 热滥用指电池受到外部加热。 实际上,这3种滥用情况并不是完全独立的,而是存在链式关系。 3种滥用情况的关系如图1所示。
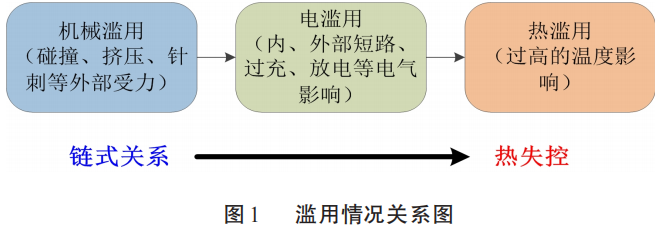
从图1可见,机械滥用先会导致电滥用,进而电滥用又会导致热滥用,最终触发热失控。 机械滥用导致电滥用的原因是,外部受力使锂电池内部隔膜破裂,促使正极与负极相连,从而引发内部短路,即电滥用的一种情况。 电滥用导致热滥用的原因是一旦锂电池内部出现短路,大量热量会被释放,更高温条件下的化学反应会被触发,这些反应又进一步地释放热量,这就相当于外部热源不断对电池加热,即热滥用。 一旦电池内部热量积累到一定程度,热失控爆发。
本文从正极、负极和电解液三方面完整地综述了锂电池内部发生的全部化学反应。 同时,根据触发温度不同,对锂电池的化学反应进行了完整梳理。 在梳理过程中,发现锂电池会析出大量气体,这些气体有别于正常情况下锂电池析出的气体,据此提出利用气体对锂电池进行热诊断的设想。
1 锂电池内部化学反应研究
1.1 理论基础
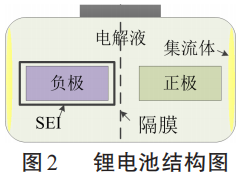
锂电池结构如图2所示,它是由正极、负极和电解液组成的。 锂电池的基本工作原理如下:
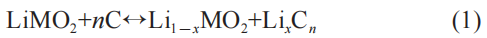
式中:LiMO2代表正极,M表示Fe、Co、Ni、Mn等活性材料; C代表负极。 式(1)从左侧向右侧进行的反应是放电反应,而从右侧向左侧进行的反应是充电反应。 对于电解液来说,它由两种或以上溶剂,一种或以上锂盐组成的。 单一溶剂在锂电池中比较少见,因为在锂电池的实际应用中,单一溶剂难以满足多种不同甚至是矛盾的要求。 我们以正极为LiCoO2,负极为C,溶剂为EC和DEC,溶质为LiPF6的磷酸铁锂电池为例进行说明。 这种正极、负极、电解液的配置是目前最为常见的。
在锂电池内部,正极和负极之间存在隔膜,不会直接反应,主要是正极和负极自身及它们分别于电解液的化学反应。 因此,本文分别从正极和电解液反应,负极和电解液反应,电解液反应三个方面对化学反应进行总结。
1.2 化学反应研究
(1)正极和电解液的反应
正极材料是在过渡金属氧化物基础上发展而来,正极材料受热存在分解反应,并放出热量:
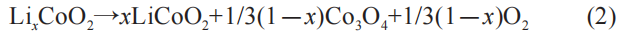
在此基础上,氧气将与电解液发生反应,并析出大量一氧化碳、二氧化碳和热量:
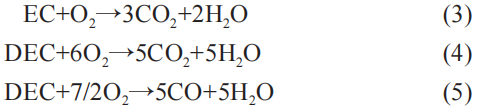
随着放出热量的增多,锂电池内部温度也明显增加,从而正极活性材料将进一步发生分解,并析出氧气:
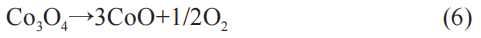
此外,DEC会与来自LiPF6的PF5发生反应,然后加速氧气的消耗,释放二氧化碳和热:
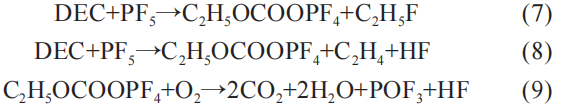
从式(2)~式(9),可见正极的热分解会释放出大量的氧气,而氧气正是发生热失控的必备因素。 另外,二氧化碳会因为氧气的存在大量析出,同时还有烟雾C2H5F。
(2)负极和电解液的反应
负极表面包裹着固态电解质界面(SEI),SEI的化成是电池生产过程中的必要工艺,SEI 用于阻止负极与电解液的直接反应。 SEI主要由不稳定成分CH2OCO2Li和稳定成分Li2CO3构成。 随着温度上升,不稳定成分CH2OCO2Li会分解,并转换为稳定成分 Li2CO3:
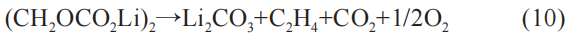
或者:
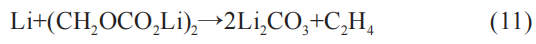
该反应的热量产生与负极的表面积直接相关。 一旦SEI分解,负极将直接暴露在电解液中,并与电解液之间反应。 若此时电解液含量较少,那么反应主要由负极主导:
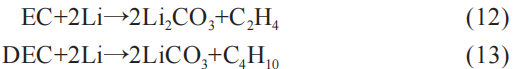
若此时电解液含量较多,那么反应主要由电解液主导:
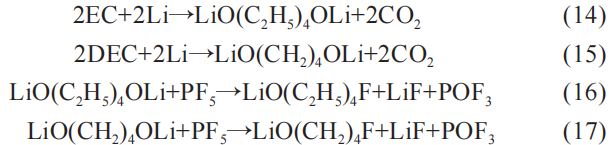
可见不同的负极与电解液容量关系也会促使不同化学反应。 粘合剂PVDF是电池制备过程中的必需品,PVDF会在电解液中发生脱氟化氢作用。 发生的化学反应为:
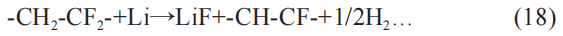
(3)电解液反应
除了正极、负极与电解液的反应外,电解液自身也会发生分解。 首先电解液中的溶质 LiPF6会发生分解反应:

式(7)和式(8)中的反应产物 PF5正是通过该反应获取。 随后DEC的产物C2H5OCOOPF4进一步发生分解反应:
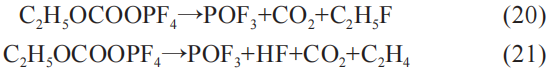
同时,C2H5OCOOPF4还会与HF进一步发生化学反应:
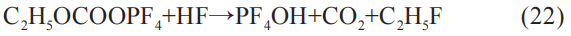
至此,式(2)~式(22)总结了以LiFePO4和C为电极,以EC和DEC为溶剂,以LiPF6为溶质制备的锂电池内部可能发生的全部化学反应。 由式(2)~式(22)可见,锂电池内部化学反应的不同,产生了不同的固体产物和气体产物,并释放大量热量。 当大量热量积累过渡后,锂电池的热失控将被触发。 固体产物总结有:Fe2O3、FeO、C2H5OCOOPF4、CH2OCO2Li、Li2CO3、 LiO(C2H5)4OLi、 LiO(CH2)4OLi、 LiO(C2H5)4F、 LiO(CH2)4F、LiF、PF4OH。 气体产物总结有:O2、CO2、C2H4、C4H10、POF3、C2H5F、PF5、H2。
1.3 化学反应触发顺序
实际上,锂电池内部的化学反应不会集中反应,而是根据触发温度不同,逐一进行的。 为了进一步清楚锂电池内部化学反应进行的顺序,对式(2)~式(22)给出的化学反应进行梳理。
(1)溶质LiPF6具有不稳定性,这导致其在较低温度60~70℃下就会发生分解,对应于式(19)。 尽管该反应在较低温度便可以进行,但放热量相对较低。 不过,LiPF6的产物PF5会促使其他反应进行。
(2) SEI 具有电子绝缘、离子传递性,它对负极起保护作用,防止负极与电解液的直接反应。 SEI的熔点在 100~130 ℃,在该温度下发生破裂,SEI中的不稳定成分转变为稳定成分,对应式(10)和式(11)。 此反应为放热反应,放热量大于溶质LiPF6反应的放热。 研究表明,SEI破裂反应所释放的热量是引起热失控的来源。
(3)一旦SEI破裂,负极不再被SEI包裹的部分将暴露在电解液中,该部分将与电解液直接反应。 根据负极暴露部分与电解液含量的关系,化学反应对应于式(12)~式(17)。 目前,已有研究指出关于负极与电解液的反应会在120~150℃和 200℃以上进行反应。
(4)在温度130~220℃范围内,LiPF6的反应物PF5会促使电解液中EC、DEC的反应,反应产物C2H5OCOOPF4在该温度范围内降进一步分解,从而生成大量副产品,对应式(7)、式(8)、式(20)~式(22)。
(5)正极在170~300℃高温下分解,发生氧化反应,释放氧气。 这些反应示于式(2)、式(5)和式(6)。 对于确定的正极活性材料,它的热稳定性与式(2)中的x有关,x越低,热稳定性越差。 对于不同的正极活性材料,他们的分解温度稍有不同 ,大致在180~280℃之间。 正极材料为LiNiO2和LiCoO2时,分解温度在180℃附近; 正极材料为LiMn2O2时,分解温度在200℃附近; 正极材料为LiFePO4时,分解温度在220℃附近; 正极材料为LiNi3/8Co1/4Mn3/8O2时,分解温度在270℃附近。
随着氧气的释放,大量氧气与溶剂EC和DEC发生反应,释放出大量二氧化碳,对应于式(3),式(4)和式(9)。 研究表明,正极自身热分解反应及正极与电解液的反应会在较短时间内释放出大量热量,造成锂电池内部热量积累,因此该反应是引发热失控的根本所在。
(6)当温度上升至230℃以上,粘合剂PVDF会被分解并释放出大量热量,对应于式(18)。 研究表明,此反应会促使热失控的程度进一步加重,恶化锂电池的安全性能。
(7)除上述反应外,在温度130~190℃范围内,还存在隔膜溶解的反应。 尽管该反应是吸热的,但一旦隔膜被溶解,会造成正极和负极之间短路,从而引发热失控。 至此,结合现有文献的研究成果,根据触发温度不同,对锂电池内部化学反应的发生次序进行了梳理。
2 预警诊断策略
对锂电池热失控的预警诊断是保证锂电池可靠工作的重要前提。 通过对锂电池内部化学反应的梳理发现,锂电池在升温过程中会析出多种气体。 换而言之,不同的气体是不同化学反应的必然产物。 因此,考虑析出气体可以作为特征量被用于锂电池热失控的预警诊断。 虽然电池管理系统能够实时测量锂电池的电流、电压和温度信息,但是电流、电压信息并不能直接反应锂电池的内部化学反应情况,同时,电池内部和外部测量到的温度有不小差异,因此考虑利用气体特征量进行判别。
将气体用于锂电池的故障预警的前提是锂电池在正常工作工况和温度升高工况下析出气体存在差异,因此需要进一步比较两种工况下,锂电池析出气体的情况。 前节分析中,所研究的气体是温度升高工况下锂电池内部化学反应析出的气体,成为异常气体。 下面分析锂电池正常工作工况下的气体,即正常气体。
锂电池的正常气体主要在SEI的化成阶段析出。 作为电池生产过程中的必要工艺,SEI的化成阶段主要是溶剂的电子反应。 溶剂包含EC和DEC,首先看EC的电子反应:
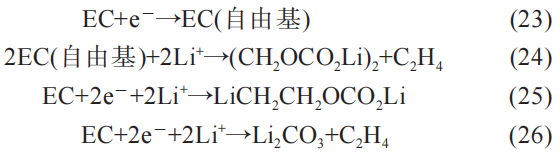
其次,DE 的电子反应:
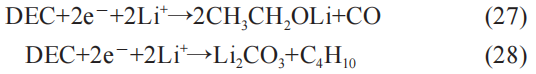
为方便对比,将正常气体和异常气体进行了整理,正常气体有:CO、C2H4和C4H10,异常气体有:CO2、CO、C2H4、C4H10、POF3、C2H5F、PF5、H2。 可见异常气体在种类上与正常气体存在较大不同。 同时,随着温度增大,内部化学反应越发剧烈,所析出气体的含量也会不断加大。 因此,跟据异常气体与正常气体的显著不同,例如气体含量,气体变化率,气体种类等方面,可以实现对锂电池热失控的预警诊断。 在操作中,需要选择针对性的传感器,并设定相应阈值进行判断。
审核编辑:汤梓红
-
【转】锂电池长期充满电存放有什么危害2016-09-03 0
-
【转】锂电池经常满电存放有什么危害?2016-10-03 0
-
温度对于锂电池包有什么影响?2018-09-25 0
-
燃料电池内的电化学反应-触媒与反应2009-11-02 646
-
锂电池内部保护威廉希尔官方网站 图2009-10-26 4075
-
锂电池内部图像2009-12-02 1124
-
隔膜对锂电池的作用及影响2019-06-13 16669
-
电动汽车安全问题 电池是如何失控的2019-06-28 1448
-
磷酸铁锂电池化学反应方程式_磷酸铁锂电池工作温度2020-03-28 51106
-
锂电池如何修复呢?2020-05-01 35611
-
锂电池热失控的解决办法2020-10-16 7703
-
软包锂电池内部的力学和化学变化2022-07-05 3069
-
锂电池热失控气体产生原因、分析方法2023-12-08 1234
-
锂离子电池热失控过程,不同锂电池热失控反应一样吗?2024-01-10 662
-
了解锂电池热失控:原因及预防2024-07-11 927
全部0条评论

快来发表一下你的评论吧 !

