

DSP用于癌症相关研究案例分享
描述
癌症早期发生过程,发展进程,肿瘤转移,治疗过程及耐药等过程,以及新一代的肿瘤治疗研究及解决方案,都离不开对于肿瘤微环境的深入理解。DSP独特基于组织形态学marker标记及空间位置精确分割捕获技术,为肿瘤发生发展过程的理解,治疗过程中作用机制的理解,及癌变早期标志物筛选和治疗监测提供了全新的筛选工具。 以下我们通过研读几篇具体案例,来了解一下GeoMx Digital Spatial Profiler (简称DSP)在肿瘤相关研究中的常见经典研究思路~~ 研究案例一 文章题目:干细胞样肿瘤细胞的Midkine表达驱动mTOR抑制和免疫抑制微环境的持续 影响因子:17.694; 发表时间:2022.08; 发表期刊:Nature Communications
mTORC1在多种癌症类型中异常活跃。此研究对结节性硬化综合症(TSC)与mTORC1极度活跃相关的肿瘤进行了单细胞转录组分析、配对T细胞受体(TCR)测序和空间转录组分析,并通过肿瘤调节的免疫抑制性巨噬细胞确定了一种与T细胞功能障碍有关的干细胞样肿瘤细胞状态(SLS)。雷帕霉素及其衍生物(rapalogs)是治疗TSC肿瘤的主要药物,干细胞样肿瘤细胞在体外表现出雷帕霉素耐药,这让研究者联想到这些药物对患者细胞的抑制作用。促血管生成因子midkine (MDK)在SLS群体中高度表达,并在SLS优势样本中与内皮细胞的富集相关。MDK抑制与雷帕霉素在体内外协同抑制TSC细胞系的生长。综上所述,本研究提示mTORC1高活性的干细胞样状态肿瘤细胞通过免疫抑制,存在一种自分泌雷帕霉素耐药机制和旁分泌肿瘤生存机制。
实验设计:
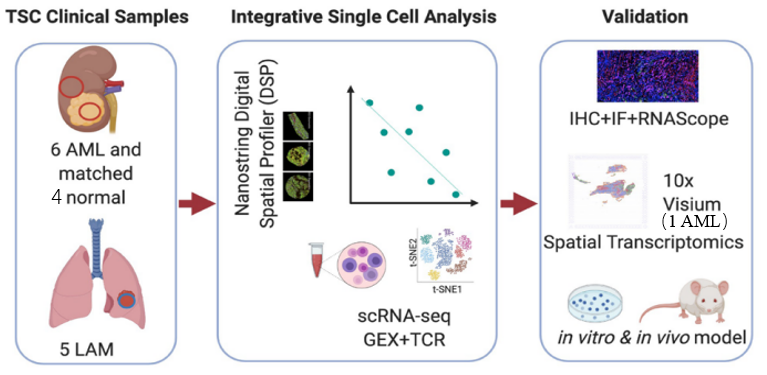
DSP(1个SLS+1个IS):探究肿瘤空间微环境
研究案例二 文章题目:DSP技术+snRNA-seq揭示PDAC在CRT治疗后多层次重构 影响因子:41.307;
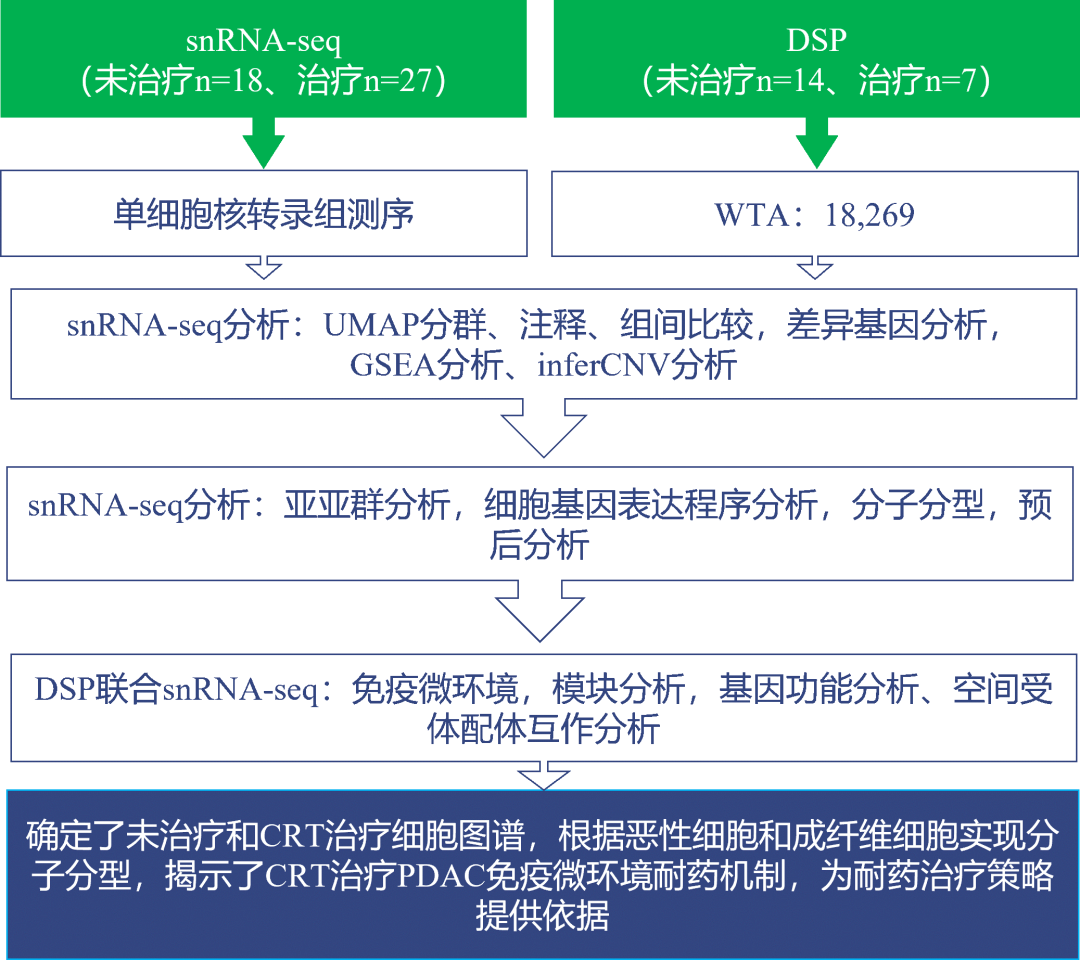
Bulk方法以及胰腺导管癌的研究都是针对未治疗的病人,对治疗中病人的肿瘤微环境的变化不清楚。CRT治疗是一种无创治疗并且在近年来发展迅速,但CRT治疗的耐药性依然没有有效的治疗策略。此研究联合snRNA-seq+DSP技术对胰腺导管癌未治疗和CRT治疗后的组织进行分析,发现CRT治疗诱导了恶性细胞和成纤维细胞表型的转变,根据两种细胞的基因表达程序构建了能够有效预测PDAC预后效果的分子分型,并结合空间转录组技术揭示了CRT治疗引起PDAC发生耐药的机制,为不同的耐药治疗策略提供依据。技术路线:
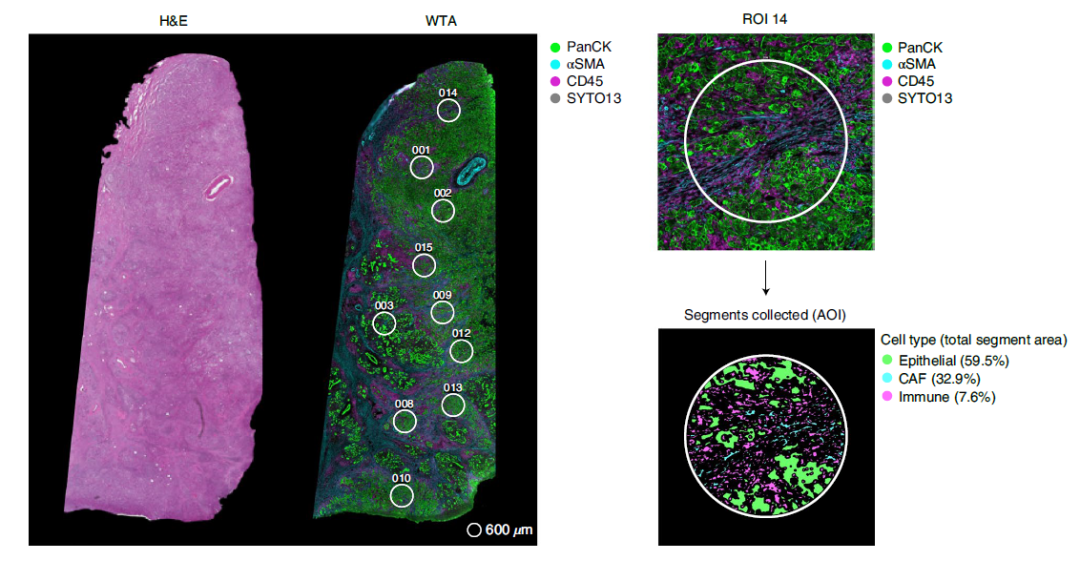
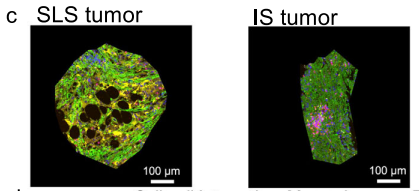
DSP选区示意图
主要结论:1. 构建未治疗和CRT治疗后胰腺导管癌的sn-RNA单细胞图谱; 2. CRT治疗促进经典样恶性细胞向基底样恶性细胞转化并导致耐药; 3. 根据恶性细胞和癌症相关的成纤维细胞(CAF)建立精细的分子分型,有助于PDAC的预后风险评估; 4. 基底样恶性细胞和经典样恶性细胞免疫浸润不同,提示在治疗中采用不同的策略(前一种采用免疫检查点抑制剂、后一种采用CD40激动剂和TGF-β调节剂)。
研究案例三 文章题目:导管内乳头状黏液性肿瘤的数字空间分析:迈向风险分层的分子框架 影响因子:14.957; 发表时间:2023.03;
导管内乳头状粘液性肿瘤 (IPMN) 的组织病理学异质性使胰腺导管腺癌 (PDAC) 风险的预测变得复杂。胰胆管 (PB)、肠 (INT) 和胃小凹 (GF) 上皮的肿瘤内区域可能伴有低度异型增生 (LGD) 或高度异型增生 (HGD)。研究者使用异型增生上皮的数字空间RNA分析 (83个区域)从手术切除的IPMN组织(12 名患者)中区分亚型并预测与恶性肿瘤相关的基因。PB和GF病变的表达模式与INT不同,表明PB和GF起源于共同的谱系。
PB病变内的转录失调反映了PDAC的转录失调,而INT和GF病灶则没有。肿瘤坏死因子/核因子κB (TNF-NFκB) 和细胞周期(循环S和循环G2-M)程序分别在PB和INT亚型中相对突出。总之,这项研究描绘了高风险IPMN的标志物和对恶性进展的洞察。
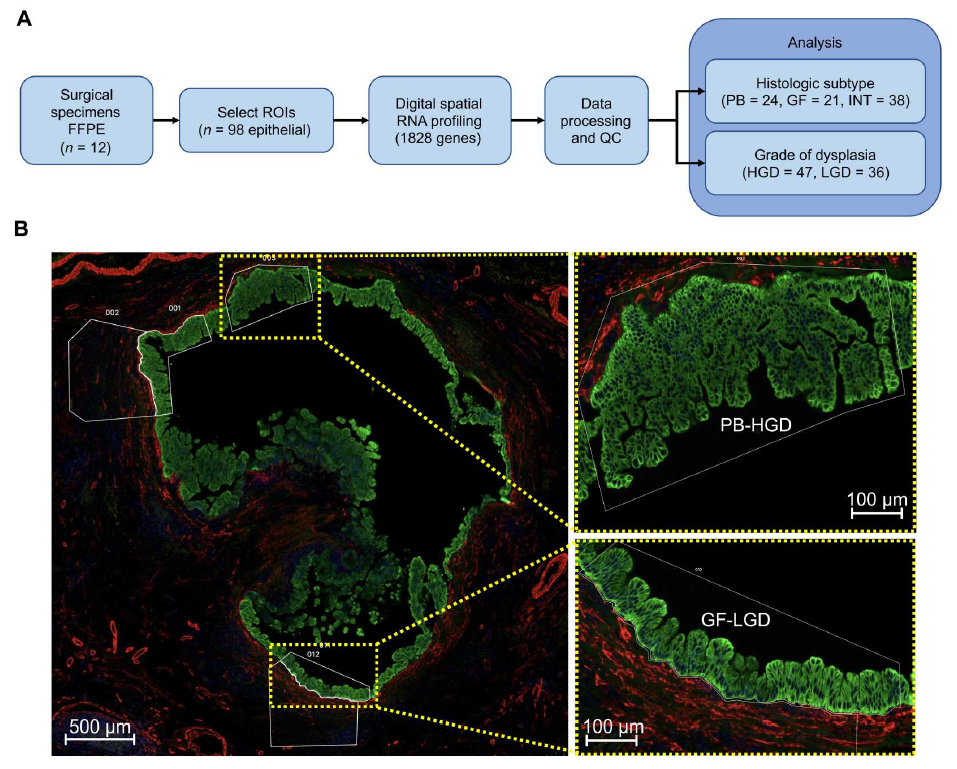
IPMN的空间RNA谱分析
关于SBC中心实验室
SBC中心实验室聚焦单细胞、空间多组学前沿技术,围绕基因组、表观组、转录组、蛋白组、代谢组和微生物组等多维组学研究,以国际一流水平的技术平台,二十余年专业经验的技术团队,打造创新产品服务体系,高效助力科学发现产品研发。中心始终以严谨的科学态度,坚持创新,服务国家重大战略任务,推动技术成果转化应用和带动产业集群发展。长期举办学术william hill官网 、专题研讨会、前沿技术培训,为数十家跨国制药企业和上千家国内科研机构、院校、医院提供系统全面一站式的科研与转化解决方案,日益发挥面向生物医药全行业功能效益和策源动力。
-
DSP运算方法研究2012-08-19 0
-
新世纪的癌症“占卜师”——TAP检测2014-06-13 0
-
做AI+癌症诊断 巨头们的“小算盘”依然变现难2018-10-23 0
-
能听到癌症呻吟的传感器2018-10-26 0
-
LabVIEW进行癌症预测模型研究2023-12-13 0
-
DSP 用于电力线载波通信研究2010-04-02 490
-
基于dsp的svpwm的算法研究2016-04-15 460
-
用于电火花加工机床的直流直线电机DSP控制技术研究2016-05-05 713
-
AI应用于癌症治疗,将给癌症患者或潜在患者带来福音2018-07-11 1267
-
Paige.AI将机器学习引进癌症病理研究2018-02-26 966
-
医学研究员Viksit Kumar:AI和深度学习有助于癌症的治疗2018-07-12 3968
-
人工智能验血 能对不同类型的癌症做出区分2020-03-13 700
-
识别癌症标志物的DNA纳米机器综述和分析2021-01-04 2649
-
Valo Health正在研究涉及不同癌症的多个靶标2021-01-21 1714
-
NVIDIA加速计算技术助力癌症研究2024-10-29 274
全部0条评论

快来发表一下你的评论吧 !

