

用于结直肠癌早期诊断的的外泌体检测平台
描述
外泌体因其具有丰富的生物信息和高稳定性,被认为是结直肠癌(colorectal cancer,CRC)诊断的新型生物标志物。然而,对于具有特异性表面受体的外泌体的准确检测限制了其临床应用。
近期,山东大学齐鲁医学院杜鲁涛教授课题组在Small期刊上发表了题为“Construction of Exosome SORL1 Detection Platform Based on 3D Porous Microfluidic Chip and its Application in Early Diagnosis of Colorectal Cancer”的文章,构建了3D多孔海绵微流控芯片上的外泌体富集平台,该芯片的外泌体捕获效率约为90%。此外,研究人员通过深度质谱分析后进行多级表达筛选,揭示了CRC特异性外泌体膜蛋白(SORL1),并进一步设计了一种基于特定量子点标记的SORL1检测方法,通过对64张荧光图像进行特征提取,建立了集成分类系统。使用该系统的曲线下面积(AUC)为0.99,明显高于使用传统生物标志物。上述系统在处理早期、进展期和CEA阴性结直肠癌患者时表现出类似的诊断性能。

为克服近表面流体动力学阻力,提高表面体积比,并增强微通道内的传质,研究人员设计并构建了新型多孔海绵芯片。该平台由简单制备而成的聚二甲基硅氧烷(PDMS)预聚体、固化剂、研磨NaCl微粒生成硬模板。通过调节模板与PDMS预聚体的混合比例和NaCl粉末的直径,从而改变微流控芯片中PDMS海绵的多孔结构(图1A)。针对CRC患者,通过质谱蛋白组学分析筛选到一个新的外泌体表面蛋白SORL1,并通过蛋白质印迹法(Western blotting,WB)和流式细胞术检测进行验证。接着,利用构建的多孔海绵芯片和硅量子点(Si-QD)共轭捕获抗体检测CRC患者血清中外泌体SORL1的表达(图1B)。最后,将获得的荧光图像使用基于AI的集成分类系统进行分析和量化,该系统可以高效准确地区分CRC患者和非CRC人群(图1C)。
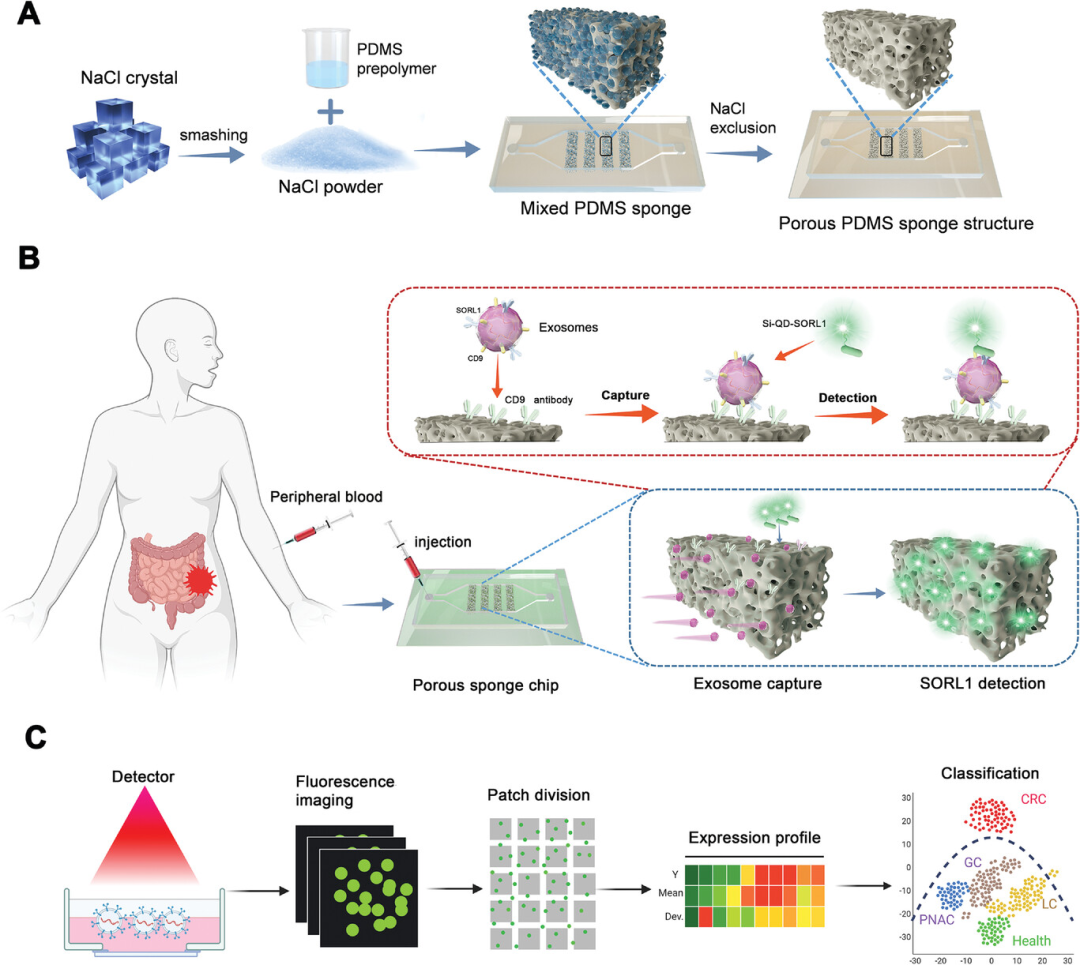
图1 3D多孔海绵芯片的构建及外泌体的分析
为了实现对CRC来源外泌体的高灵敏度检测,研究人员首先使用球磨机研磨NaCl颗粒形成均匀的粉末。如图2A所示,未处理的NaCl平均粒径在粉碎后由176 µm ± 35 µm减小到3.35 µm ± 0.87 µm,说明粉碎方法可以有效降低NaCl平均粒径。多孔海绵芯片的实物图和渲染图如图2B所示。芯片(左上面板)中心的白色区域是多孔PDMS海绵结构,在相邻的多孔结构之间具有凹槽,以破坏层流。多孔PDMS结构的表面和断面扫描电子显微镜(SEM)图像也显示了具有相互连通的孔洞的多孔形貌。该研究利用PDMS可以非特异性地大量吸附蛋白质的原理,将抗体高效地固定在芯片内部的多孔PDMS结构上。使用CD9抗体进行固定以捕获外泌体,并选择两种抗体固定方法:分别在37℃孵育2 h和4℃孵育过夜。为了探究最佳的抗体固定方法,使用荧光显微镜对芯片进行荧光成像。以FITC二抗的荧光强度用来评价一抗固定效果。对于BSA和PBS孵育的两组芯片,非特异性荧光吸附较弱,两组芯片的荧光强度均远低于CD9抗体孵育组(图2C)。37℃孵育2 h后的抗体固定量是4℃孵育过夜的4.797倍,表明37°C孵育2 h是抗体固定的最佳条件。
随后,研究人员通过超速离心法从SW1116细胞的培养上清中获得纯化的结肠癌外泌体。采用透射电子显微镜(TEM)、Western blotting和纳米颗粒跟踪分析(NTA)3种应用最广泛的外泌体分析方法对分离的外泌体进行性质表征。图2D显示了标准的外泌体形态,包括圆形或椭球形。采用NTA分析外泌体浓度和平均直径。粒径为103.1 nm,峰浓度为7.7 × 10⁶,与文献报道一致(图2E)。利用Western blotting鉴定出癌细胞和外泌体膜靶蛋白CD9、CD63和TSG101(图2F)。随着样品的持续进样,芯片的实时荧光捕获效率逐渐降低。20 µL时荧光强度(ΔFL)最高为97.45% ± 2.29%,100 µL时ΔFL最低为74.45% ± 8.8%,ΔFL的平均荧光效率为85.25% ± 5.51%(图2G)。多孔海绵芯片的NTA捕获效率为80.12% ± 3.45%,而超速离心仅为15.5% ± 1.70%(图2H)。荧光图像进一步揭示了外泌体具有较高的捕获效率(图2I)。NTA和荧光分析得到的结果一致,证明了多孔海绵芯片分离和捕获外泌体的高效性。
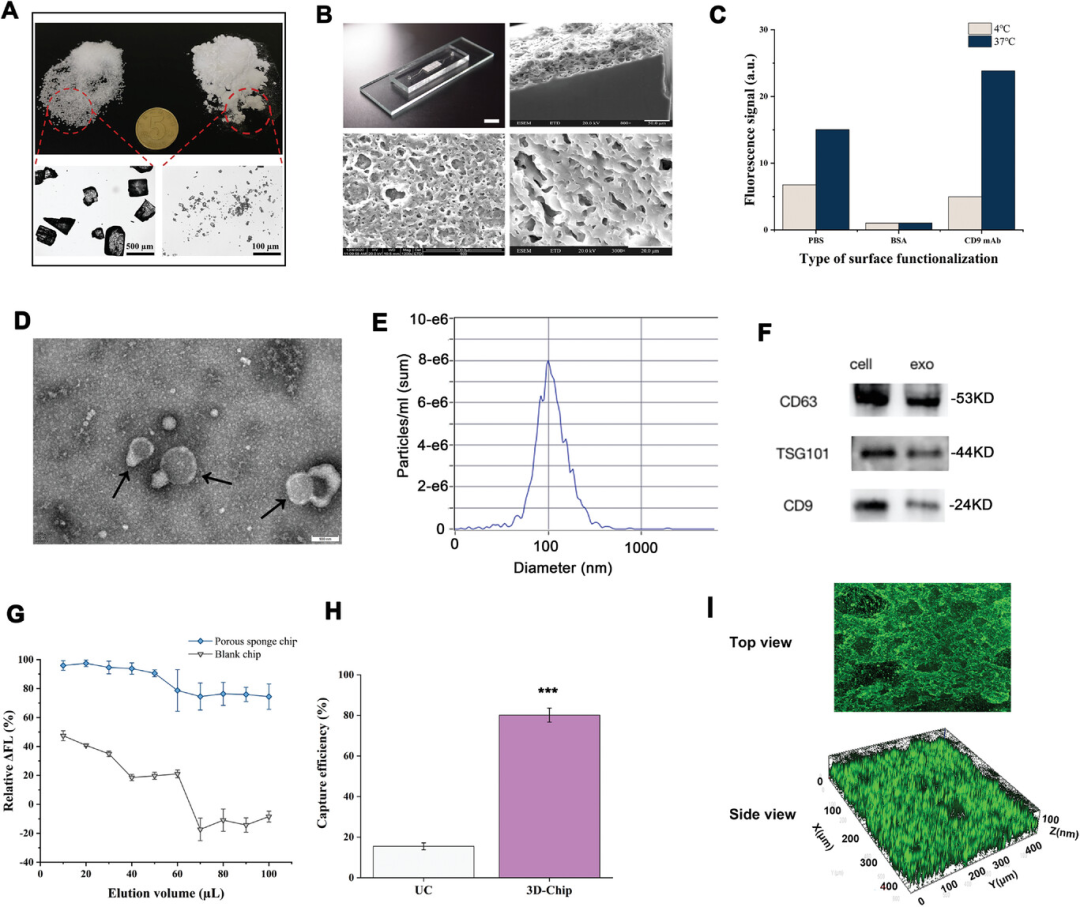
图2 外泌体和3D多孔海绵芯片的表征 接着,研究人员初步选取8例健康人(HCs)和8例CRC患者的血清样本,对收集到的血清外泌体进行无标记蛋白质组学分析。与HCs相比,CRC患者中共鉴定出367个差异表达蛋白,其中上调蛋白136个,下调蛋白231个,包括FTH1、RPS8、CFH、PIGR、PSMA3和CCT8(图3A)。在CRC和正常样本中分别有25个蛋白和62个蛋白特异性表达。
为了验证筛选出的分子是否位于外泌体膜表面,研究人员使用SW620细胞来源的外泌体进行流式检测。结果显示,与对照组相比,CRC样本中SORL1和PSMA3的荧光强度较高,而CCT8、PIGR和CAT表达在基础水平,表明SORL1和PSMA3定位于外泌体膜表面(图3B)。接下来,通过Western blotting分析测定细胞上清和血清样本外泌体中SORL1和PSMA3蛋白的表达水平。结果显示,在CRC细胞培养上清中可以稳定检测到SORL1和PSMA3(图3C)。此外,与HCs相比,SORL1在CRC患者血清中表现出更高的表达,而PSMA3的表达无统计学意义(图3D)。通过对27例CRC患者和27例HCs血清中外泌体SORL1的定量检测,研究人员证实了CRC患者血清中SORL1的水平显著高于HCs,表明外泌体SORL1在区分结直肠癌患者和非结直肠癌人群中的潜在诊断价值(图3E)。
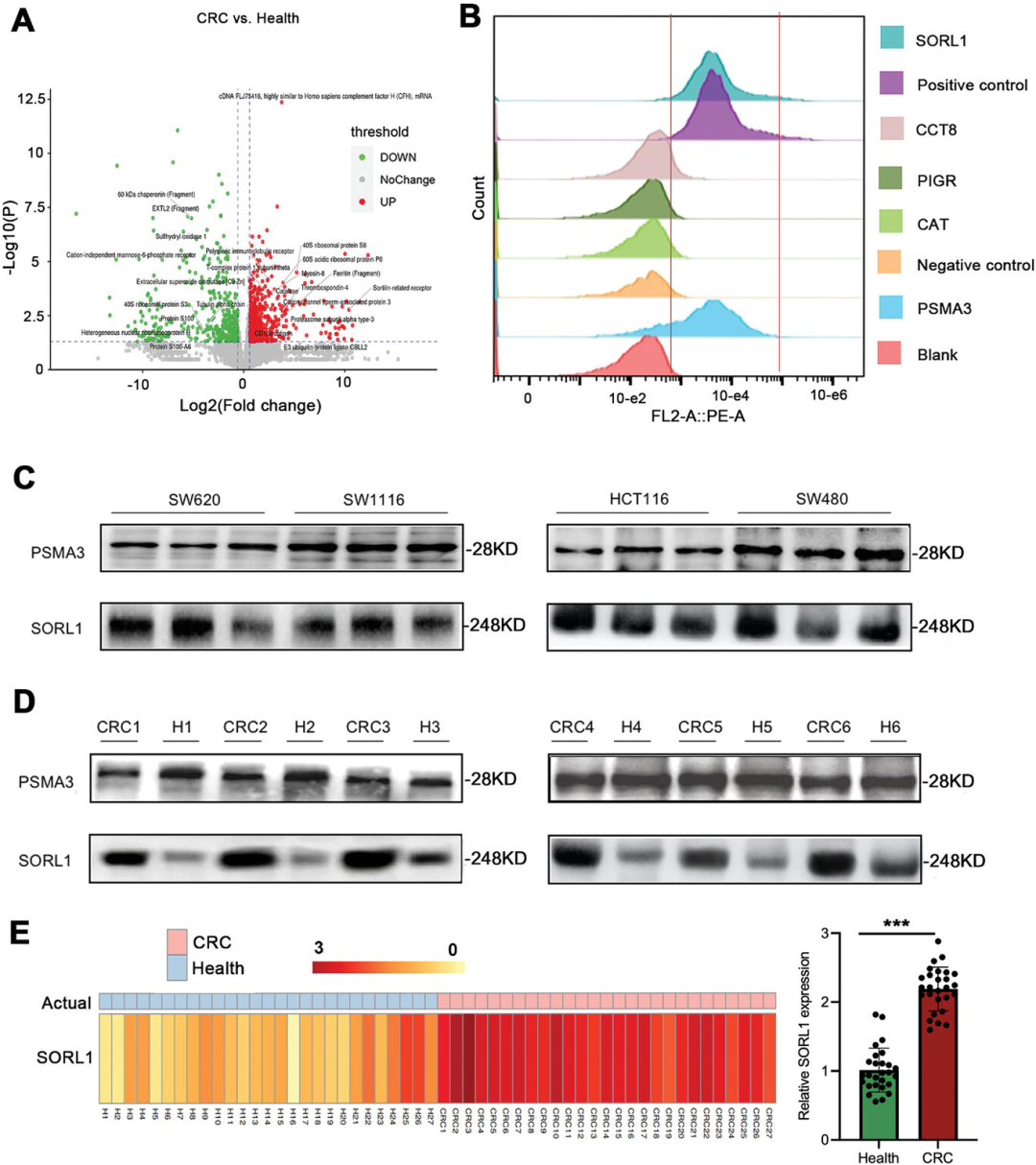
图3 无标记定量蛋白质组学对外泌体蛋白的分析
为了利用3D微流控芯片有效定量SORL1的表达,研究人员制备了Si-QD偶联的SORL1抗体(Si-QD-SORL1)。TEM结果表明Si-QD和SORL1抗体融合,成功合成了Si-QD-SORL1复合物(图4A)。UV-vis光谱扫描结果证明Si-QD在357 nm处有明显的吸收峰,加入SORL1抗体形成Si-QD-SORL1复合物后,吸收峰明显减弱(图4B)。将3D多孔芯片与Si-QD-SORL1结合后,在室温下放置10 min、30 min、50 min、70 min和90 min后评估荧光强度稳定性。结果表明,在所考察的时间范围内,荧光强度无明显变化,表明Si-QD-SORL1复合物具有较高的稳定性(图4C)。为了确认注入芯片的样品荧光强度是饱和且稳定的,研究人员测试了多孔芯片组合的最佳Si-QD-SORL1的体积和浓度。根据图4D所示,芯片从左到右有3个捕获区域,捕获区域的荧光分布均匀稳定,能够准确反映外泌体SORL1的整体表达情况(图4E)。此外,研究人员对外泌体进行PKH67-green染色,观察到Si-QD-SORL1(红色信号)与CD9结合的外泌体共定位(图4F)。这证实了荧光信号是通过两步免疫反应检测通道中的量子点产生的。
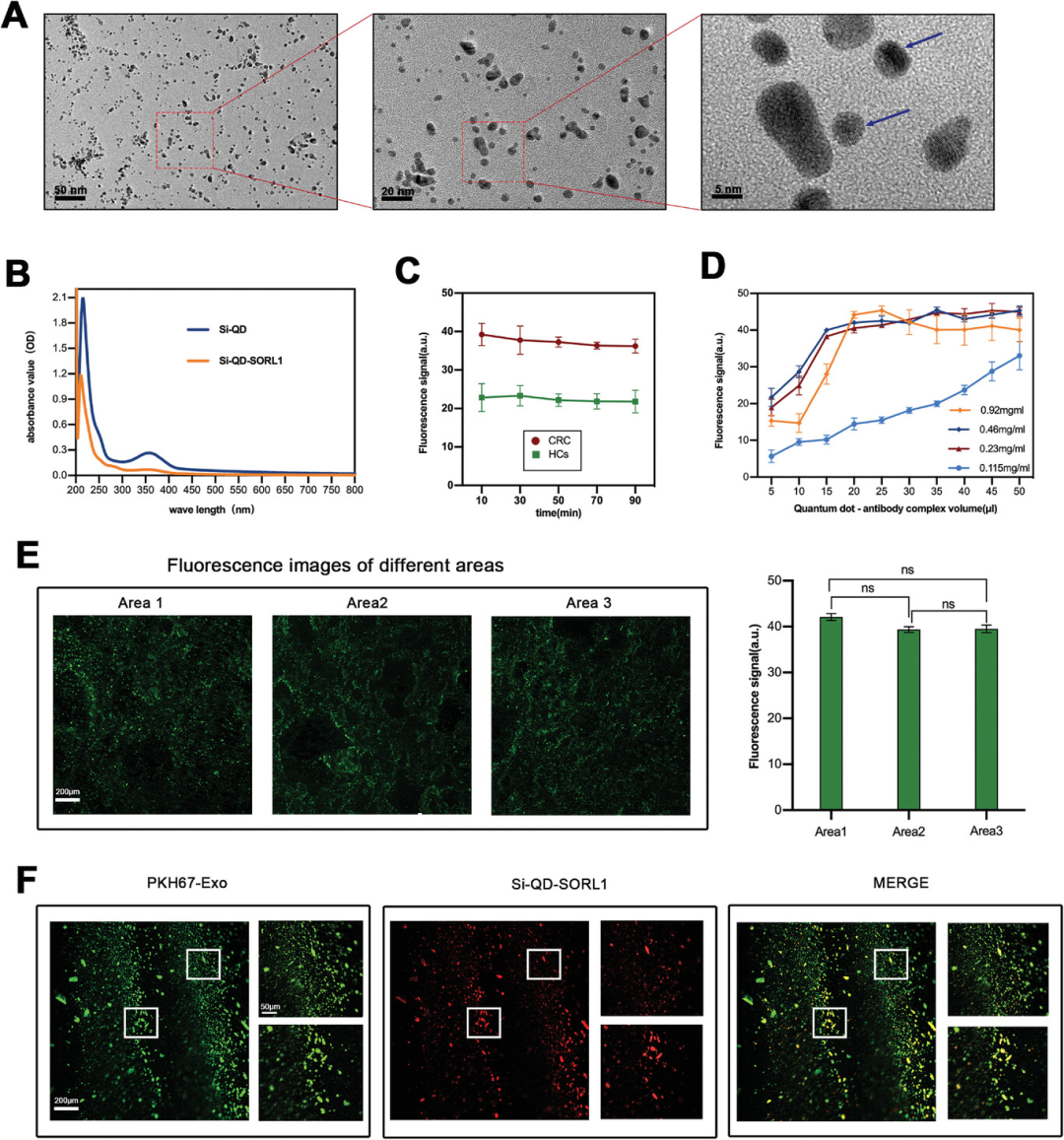
图4 Si-QD-SORL1及外泌体检测系统的表征
为了更好地理解和准确判读荧光成像结果,研究人员通过激光扫描共聚焦显微镜(CLSM)高分辨率荧光筛选,开发、训练和优化了图像检测模块。首先,为了提高集成系统的解译效果,系统将影像划分为64个图斑,并基于亮度、方差和均值3个特征获取信息(图5A)。接下来,研究人员招募了一个独立、匹配和随机分配的人群队列,包括106名CRC和100名HC,并将其分为训练和测试阶段。在训练阶段采用随机森林分析建立临床判别模型,在测试阶段采用交叉验证。为了验证外泌体SORL1区分CRC患者和HC的能力,研究人员随机选取了27例CRC患者和25例HC患者作为训练集,其余样本在测试集中进行表征。结果显示,与健康人相比,SORL1在CRC患者样本中显著上调(图5B)。91.14%的CRC患者(79人中有72人)和100%的HCs被正确诊断(图5C),同时具有达到0.99的工作特征曲线下面积(AUC)(图5D)。同时,研究人员也考察了外泌体SORL1在其他几个特定人群。他们检测了该方法对80例早期CRC患者(期和Ⅱ期)的诊断性能。结果表明,早期CRC患者和HCs的样本可以被有效区分(图5E),其诊断灵敏度达到97.50%,AUC为0.99(图5F、5G),具有较好的诊断准确性。
目前对于50岁以下的低中危人群的CRC筛查尚未达成(young CRC patients,yCRC)。在yCRC人群中,该方法的结果清楚地揭示了外泌体SORL1可以区分yCRC患者和HCs,诊断敏感性和特异性均达到100%(图5H)。但对于yCRC的诊断结果可能需要进一步的研究,因为该研究仅有12例yCRC患者。在该研究中,研究人员同时增加了35个肿瘤样本,包括12个胃癌(gastric cancer,GC)、12个肺癌(lung cancer,LC)和11个胰腺癌(pancreatic cancer,PANC)样本,以验证SORL1是否在CRC中特异性表达。利用上述35例肿瘤样本,随机选取35例健康对照者,共形成70例样本,构成非CRC对照组。结果表明,SORL1可以从非CRC癌症患者中诊断CRC患者,灵敏度和特异度分别达到93.67%和96.15%(图5I)。
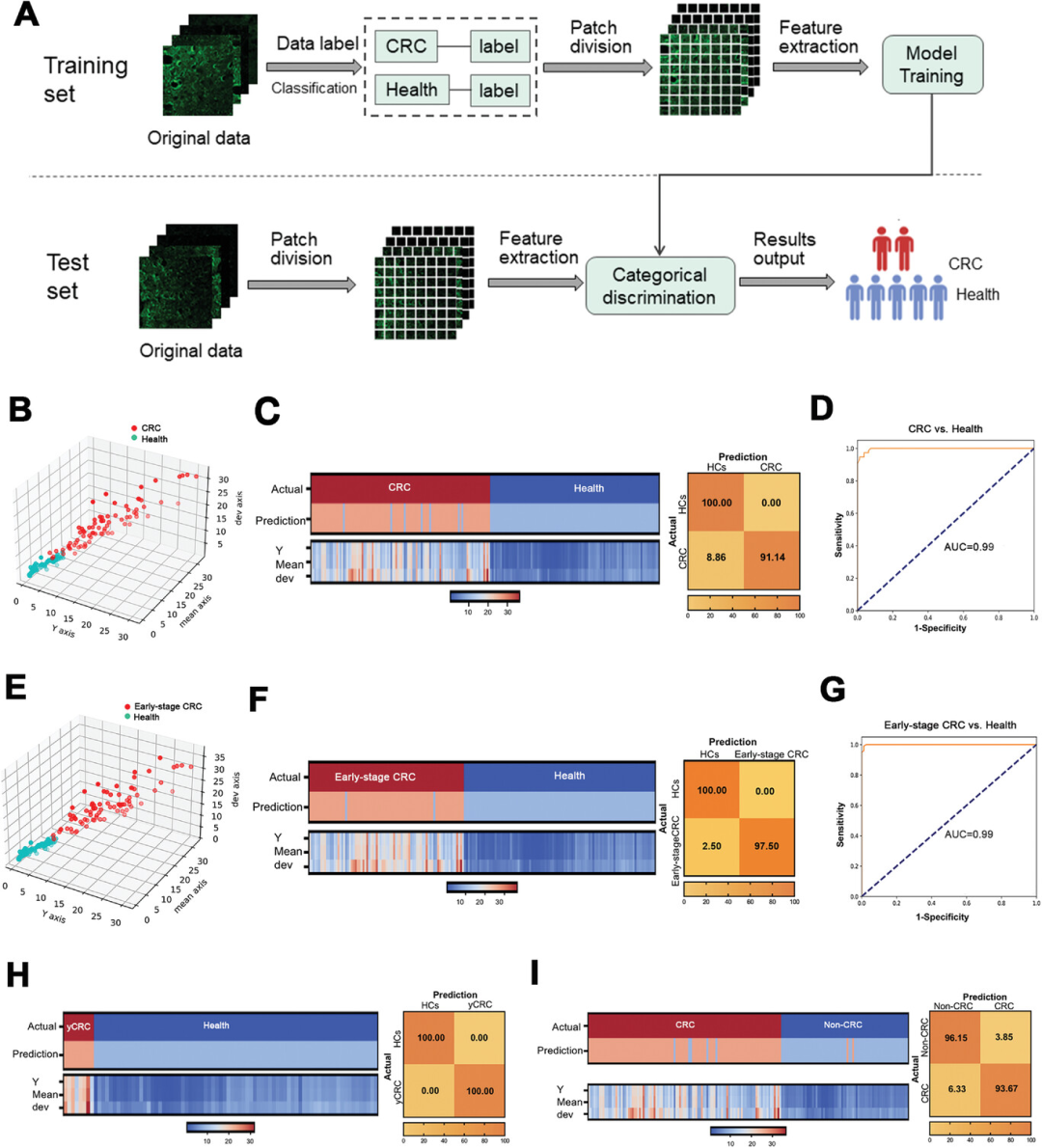
图5 基于AI分类的外泌体SORL1的诊断性能
单一标志物CEA检测常用于血液学CRC筛查。结果显示,CEA的诊断敏感性为47.17%,在106例CRC患者中仅有50例被正确诊断(图6A、6B)。而超过一半的早期CRC病例CEA阴性,表明其在早期CRC患者中的诊断能力较差。进一步研究发现,在56例CEA阴性患者中,52例患者被本研究提出的方法正确诊断(图6C),诊断AUC为0.99(图6D)。
该研究的方法的潜在应用在两个病例中得到了肯定,这两个病例通过该研究发展的方法得以正确诊断,而其被CEA、上皮细胞粘附分子(EpCAM)和结肠镜检查遗漏了(图6E)。一号病人因排便不规律而入院。结肠镜检查显示无明显恶性特征,诊断为良性息肉(图6F)。然而,术后病理报告证实了高级别上皮内瘤变(图6F)。第二例患者也出现了类似的情况,该患者使用基于SORL1的微流控芯片方法诊断为CRC,病理证实为原位I期CRC,但CEA和EpCAM未发现(图6E、6F)。这些结果有力地证明了外泌体SORL1在检测微小肿瘤和早期CRC方面的优势。
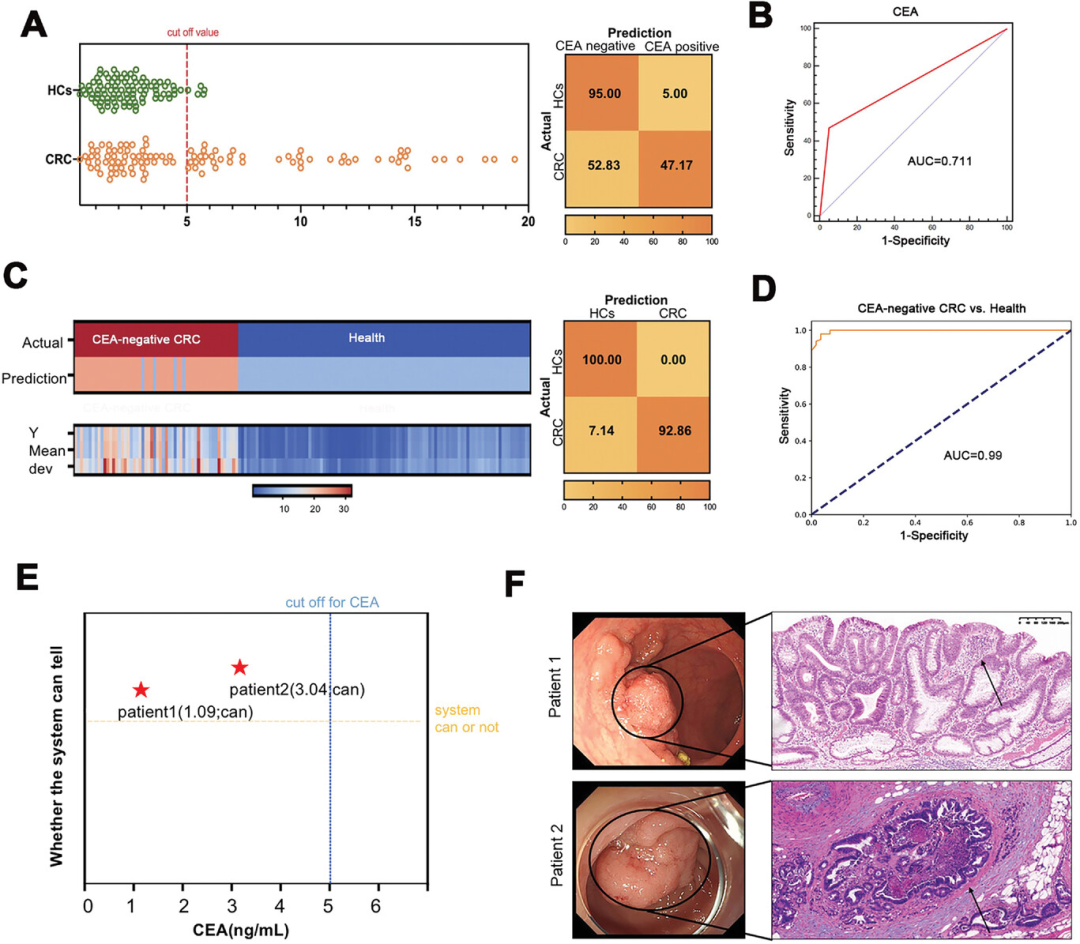
图6 通过SORL1等方法诊断CRC
综上所述,该研究通过在微流控芯片上构建3D多孔海绵结构,将其与新发现的CRC分子标记物SORL1、量子点检测方法和机器学习智能分析系统相结合,建立了一种新型特异高效的检测技术平台。该平台能够实现外泌体在芯片表面的高度富集,便于快速捕获和定量检测。新建立的智能图像判别系统能够高效地实现CRC的早期诊断,为CRC的早期检测提供了新方法和新途径。
审核编辑:刘清
-
分析机器人与腹腔镜在直肠癌手术上哪个效果好2017-09-29 2060
-
AI诊断结肠直肠癌,准确率达86%2017-10-31 917
-
新突破!腾讯觅影联手医学研究中心降低结直肠癌的发病率和死亡率2018-07-10 1019
-
一种用于外泌体分离富集和检测的微流控芯片2018-12-31 4886
-
日本用特殊酵素检测微量气体,有利于早期诊断糖尿病和癌症2019-12-30 2585
-
胶囊扫描系统或将成为结直肠癌筛查的新突破2020-03-21 904
-
全球首获FDA批准的人工智能检测结直肠息肉系统模块诞生2021-04-18 2013
-
机器学习和智能算法在单外泌体的多维检测方面的机遇和挑战2022-12-14 927
-
基于磁学检测体系的肿瘤外泌体检测系统,为肿瘤标志物检测提供新技术2023-11-12 749
-
基于印刷工艺的分区光学生物芯片用于外泌体可视化检测2023-12-22 766
-
一种基于可拉伸光子晶体的荧光传感阵列,用于卵巢癌早期诊断2024-05-19 842
全部0条评论

快来发表一下你的评论吧 !

