

基于“血糖仪+智能手机”的微流控装置,用于嗜铬细胞瘤的即时诊断
描述
嗜铬细胞瘤(PCC)是起源于肾上腺髓质、交感神经节或其他嗜铬组织的神经内分泌肿瘤。在PCC的早期阶段没有明显的症状,但在极端压力下,患者可能出现血压剧烈波动或神经内分泌紊乱的症状,严重者可危及生命。因此,及早发现嗜铬细胞瘤,可为病人赢得最佳治疗时间。对嗜铬细胞瘤(PCC)的早期诊断可通过检测循环肿瘤细胞(CTCs)实现。
据麦姆斯咨询报道,为了实现CTCs的快速、便携、高通量检测,中国药科大学李曹龙和王飞团队将智能手机应用程序与商用便携式血糖仪(PGM)相结合,构建了一种基于Au@CuMOF级联酶的CTCs即时检测微流控装置。在该微流控系统中,研究人员采用1,4,7,10-四氮杂环十二烷-1,4,7,10-四羧酸(DOTA)和去甲肾上腺素(NE)修饰的Au@CuMOF信号探针和Fe₃O₄@SiO₂捕获探针对数量稀少的PCC-CTCs进行双重识别和捕获。
然后,Au@CuMOF级联纳米酶靶向结合CTCs,使得细胞复合物同时具有类葡萄糖氧化酶活性和类过氧化物酶活性,进一步催化葡萄糖还原,由此构建了比色法和便携式血糖仪(PGM)双模式的CTCs检测法。相关研究成果以“Cascaded nanozyme-based high-throughput microfluidic device integrating with glucometer and smartphone for point-of-care pheochromocytoma diagnosis”为题发表在Biosensors and Bioelectronics期刊上。
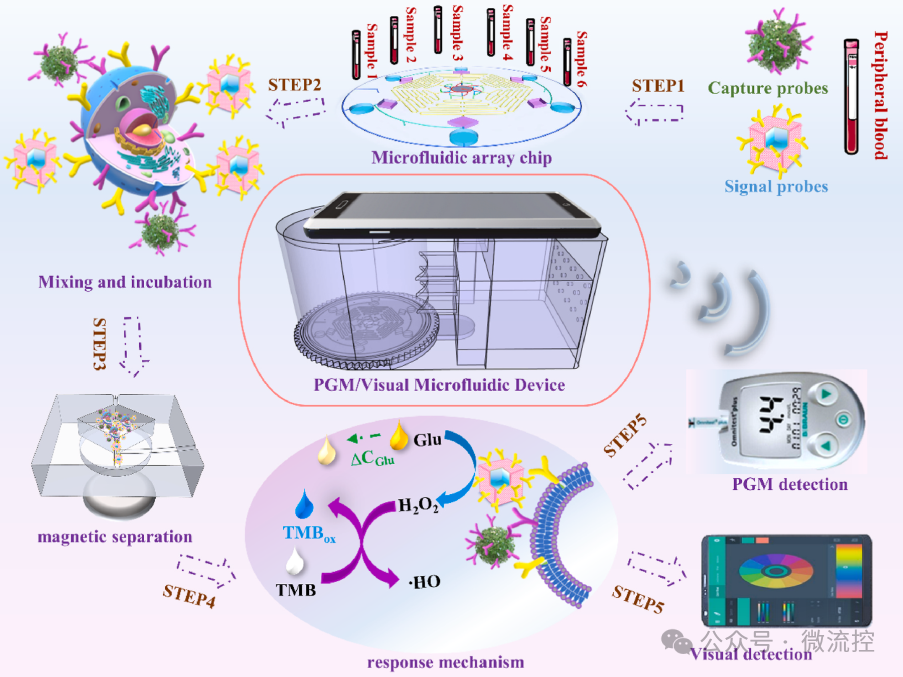
一种同时捕获和识别CTCs的微流控装置原理图
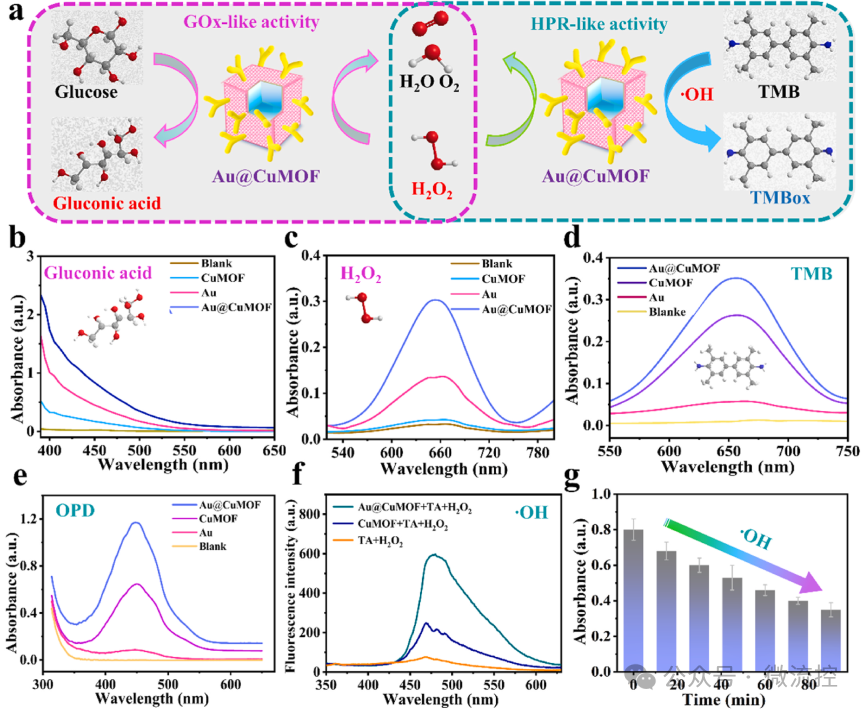
Au@CuMOF纳米盒的级联纳米酶活性
微流控装置的设计是在计算机辅助设计(CAD)软件中完成的,然后通过传统的软光刻工艺制作而成。该微流控平台将多重通道集成到单个芯片中,可同时检测六种不同的病人样本。每个独立的检测单元都包含一个微混合器通道(Ф = 0.5毫米)、分离室(4毫米 × 3毫米)和可视检测室(直径0.6厘米)。此外,微流控阵列芯片有六个样品入口用于采集细胞混合物样品,三个3,3',5,5'-四甲基联苯胺(TMB)入口用于视觉分析,六个出口用于基于PGM的葡萄糖检测。
为了验证阵列微流控装置的磁分离性能,研究人员通过显微镜成像研究了Fe₃O₄@SiO₂-NE捕获探针对隔离通道中PC12细胞的原位捕获能力。NE功能化的纳米探针可以通过NE与目标CTCs上表达的去甲肾上腺素转运蛋白(NET)之间的选择性相互作用特异性地靶向PC12细胞。
在外加磁场的作用下,细胞/探针复合体被截留在分离通道的底部,实现了对CTCs的精确捕获和分离。随着液体流动时间的延长,捕获效率逐渐提高,在分离通道中30分钟时达到最高。结果表明,结合磁场的微流控策略可以在复杂环境中原位捕获PCC-CTCs,从而实现进一步的临床检测和早期诊断。

微流控芯片捕获CTCs的表征
总体而言,便携式血糖仪、智能手机和阵列微流控芯片的结合,使PCC的快速、便携、高通量诊断成为可能,为各种癌症的传统液体活检诊断提供了一种方便、可靠的替代方案。
论文链接: https://doi.org/10.1016/j.bios.2024.116105
审核编辑:刘清
-
“医”军突起,医疗电子厂商掘金血糖仪市场2010-11-24 0
-
电子血糖仪怎么用才正确2013-04-18 0
-
血糖仪技术2013-05-30 0
-
腾讯血糖仪:糖大夫让关爱不再有距离2016-04-06 0
-
求血糖仪开发方案顾问,插入智能手机的血糖仪2016-06-25 0
-
低功耗蓝牙技术给医疗带来了什么益处,蓝牙血糖仪有哪些黑科技!2017-03-15 0
-
低功耗蓝牙技术给血糖仪带来了哪些改革!2017-04-10 0
-
你怎么定义智能手机壳,觉得高科技+手机壳=智能手机壳吗?!2018-01-05 0
-
AMEYA360设计方案丨便携式血糖监测仪解决方案2018-10-15 0
-
Maxim血糖仪产品解决方案应用2012-09-26 1772
-
罗氏血糖仪的内部构造及应用设计2021-04-14 9186
-
澎湃微PT32x033系列|血糖仪专题技术文章连载_072023-11-07 859
-
澎湃微PT32x033系列|血糖仪专题技术文章连载_062023-11-07 639
-
智能血糖仪_微型血糖检测仪定制_基于联发科MTK8788血糖仪方案2023-12-07 676
全部0条评论

快来发表一下你的评论吧 !

