

哈尔滨工业大学在超分辨显微成像技术领域取得突破性进展
电子说
描述

近日,哈尔滨工业大学仪器学院先进光电成像技术研究室(IPIC)李浩宇教授团队在生物医学超分辨显微成像技术领域取得突破性进展。针对目前活体细胞超分辨成像领域中光子效率不足的难题,团队提出一种基于无监督学习的自启发去噪方法,通过无监督深度学习技术,在无需大训练集和高信噪比真值图像的条件下,将光子效率提升了两个数量级,实现了在低光照条件下的温和、长时程活体成像。长期以来,现有显微成像技术无法兼顾弱光毒性、高空间分辨率和高时间分辨率等方面的需求,而该技术突破了这一瓶颈,仅使用单一噪声帧即可去噪,在转盘共焦超分辨显微系统上成功观察到了长达3小时的五维(xyz-颜色-时间)有丝分裂过程,分辨率达到90nm。该技术具有广泛的适用性,可广泛应用于各种超分辨系统,为在超分辨尺度下研究细胞器相互作用原理及其他生物医学研究提供了新的科学影像工具。9月11日,该研究成果以《自启发学习用于活细胞超分辨率显微镜去噪》(Self-inspired learning for denoising live-cell super-resolution microscopy)为题,以长文形式在线发表于国际权威杂志《自然方法学》(Nature Methods,2023年影响因子49.0)上。
活细胞超分辨荧光显微成像技术的发展目标是在生理友好的成像条件下保持足够的时空分辨率。然而,提升空间分辨率通常需要增加照明强度或延长曝光时间,同时还需匹配时间分辨率以防止运动伪影,因此活细胞超分辨成像中光子效率的提升至关重要。深度神经网络利用监督学习拟合噪声图像与干净图像之间的映射,能够显著提升光子效率,然而其需要收集大量配对的干净图像,难以应用于活细胞。无监督学习去噪方法给超分辨成像提升光子效率提供了另一种选择,但仍需要大量的噪声图像对其进行学习,去噪效果有限且数据效率低。因此,如何能在有限的数据下、在无需噪声图像对条件下,开发无监督学习去噪方法提升超分辨显微系统光子效率,实现活细胞超分辨尺度下长时程成像目标,仍是目前该领域内的挑战。
针对上述问题,李浩宇教授团队提出了一种自启发学习超分辨去噪方法(Self-inspired Noise2Noise, 以下简称SN2N)。SN2N利用超分辨系统的空间采样冗余特性设计自监督数据生成策略,从单张图像生成所需的噪声对图像作为数据集,并开发自约束学习策略,进一步提高去噪性能和数据效率,使去噪效果逼近监督学习水平。最终,SN2N能够将超分辨显微系统的光子通量提升两个数量级以上。此外,SN2N可与多种常用光学超分辨显微成像技术结合,成为一种易于使用的光子通量提升工具。该方法还包括细胞器结构的高精度分割解决方案,并提供智能预分析功能,有望促进下游高通量生物信息分类和细胞器的高精度智能分割与追踪。
四色活细胞超分辨成像——揭示细胞器互作现象
研究团队将SN2N方法进一步结合解卷积技术(RL-SN2N)提高分辨率,并应用于基于转盘共聚焦超分辨显微系统(Spinning Disk Confocal Structured Illumination Microscopy, 以下简称SD-SIM),实现了清晰的四色活细胞成像(图片1)。SN2N使得快速而复杂的细胞器动态过程得以可视化,通过对不同细胞器的轨迹和空间分布进行详细记录,追踪多个细胞器之间的相互作用事件,深入探索细胞器之间的协同作用和相互作用关系。

图1.SN2N在SD-SIM系统上的四色活细胞成像结果:线粒体(绿色)、内质网(灰色)、溶酶体(红色)、高尔基体(蓝色)。
五维活细胞长时程超分辨成像——完整记录有丝分裂过程
研究团队还使用所开发的方法在SD-SIM系统上成功实现了分辨率高达90纳米的五维(xyz-颜色-时间)长时程活细胞超分辨成像。该技术揭示了在整个细胞有丝分裂过程中内质网(洋红色)、线粒体(绿色)和细胞核(青色)之间的动态组学互作,监测时间超过3小时,为生物学家进一步探索细胞器的功能和相互作用关系提供了重要的实验依据(图片2)。
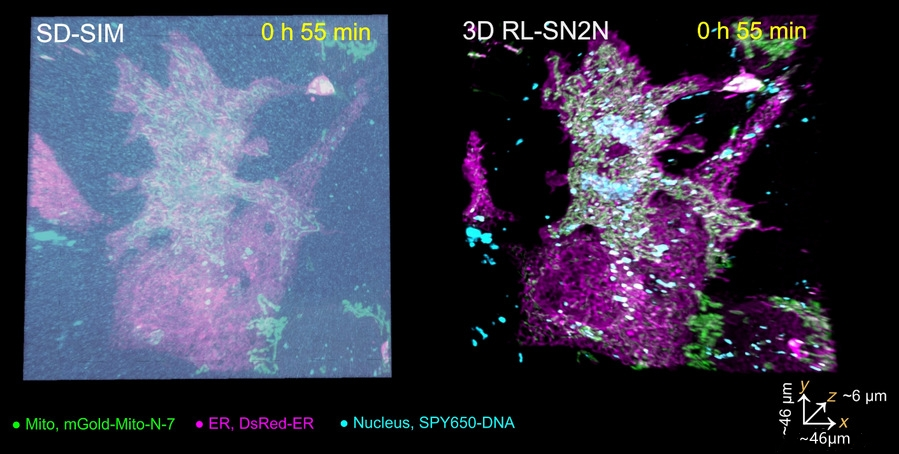
图2.SN2N实现五维长时程活细胞成像,记录有丝分裂完整过程。
形象地说,SN2N技术就像一面神奇的镜子,通过自我反射和自我启发,将模糊的图像转化为清晰的图景,把那些难以辨识的生物信息逐渐呈现出来。它就像一位出色的解密者,能够将隐藏在迷雾中的生物世界的秘密一一揭示。SN2N巧妙地利用了超分辨率显微成像系统的物理特性,无需大量匹配图像的辅助,使得活细胞温和、长时程的超分辨成像成为现实。SN2N不仅打破了传统超分辨显微成像技术在光子效率和数据需求方面的瓶颈,还能应用到多种现有的超分辨显微镜系统。通过SN2N,生物学家能够在长时程、高分辨率下,清晰地观察细胞内部复杂的动态变化,从而更精准地解读细胞的功能与机制。这一技术的应用,为深入探索细胞内部结构提供了全新的视角,同时也为生物医学研究和疾病机制的解析提供了强有力的工具。
该论文是第一篇哈工大为论文第一单位的《自然方法学》文章。哈工大仪器学院博士研究生曲丽颖为论文第一作者,北京大学赵士群副研究员和哈工大仪器学院博士研究生黄园园为论文共同第一作者。哈工大仪器学院赵唯淞教授为论文通讯作者,李浩宇教授和谭久彬院士为论文共同作者。该项工作受到科技部重点研发计划和国家自然科学基金项目资助。
审核编辑 黄宇
-
浙江工业大学在职研究生2009-06-21 0
-
粤嵌教育嵌入式技术入门与提高讲座在广东工业大学隆重举2012-04-09 0
-
广东工业大学电子设计大赛题目2012-09-21 0
-
哈尔滨工业大学-图像污损处理中求取图像加权质心点2014-07-07 0
-
【AD新闻】中国深圳先进院在高分辨率超声成像领域取得重要进展2018-03-23 0
-
NI全方位助力哈尔滨工业大学教学和创新实践2011-12-09 700
-
变频器原理与运用课件_哈尔滨工业大学精品课程2016-02-16 713
-
中国航天领域在商业航天方面发展取得突破性进展2020-11-13 3603
-
非线性光学及超分辨荧光显微成像领域取得突破性进展2022-05-05 1691
-
哈工大突破高通量超分辨显微成像难题2023-06-21 622
-
生物医学超分辨显微成像技术领域取得突破性进展2023-06-21 599
-
感谢哈尔滨工业大学对我司HS-225B恒温恒湿试验箱的认可2023-10-25 520
-
哈尔滨工业大学在微纳光学领域取得重要进展2024-04-26 288
-
闪光科技高灵敏超快成像及燃烧诊断技术交流会在西北工业大学成功举办2024-06-24 359
-
西北工业大学OpenHarmony技术俱乐部正式揭牌成立2024-11-19 291
全部0条评论

快来发表一下你的评论吧 !

