

基于自组装DNA纳米孔的生物质子器件制造
描述
纳米孔作为膜通道,能够介导信息交换,促进分子识别,然而,目前用于连接纳米孔、进行信号读出的电子设备信息传输效率较低,这成为了继续开发高性能生物电子器件的主要障碍之一。
来自加州大学圣克鲁斯分校的Marco Rolandi和来自麻省理工学院的Ashwin Gopinath团队将DNA纳米孔与生物质子电极相结合,以创建可编程的、模块化的、高效的人工离子通道接口。研究表明,胆固醇修饰的DNA纳米孔具有显著的亲和力,能够跨越平面生物质子电极表面形成的脂双层,介导质子在脂双层上的传输,识别生物分子信号。该工作以“DNA nanopores as artificial membrane channels forbioprotonics”为题,发表在Nature Communication期刊上。
首先,研究人员将合成的基于自组装DNA纳米孔的离子通道与H⁺选择性钯(Pd)电极结合在一起,创造了一种生物质子器件,该器件可以记录和调节穿过双层膜的H⁺电流(图1)。如图1所示,DNA纳米孔跨越脂质双层膜,该膜位于与微流控结构集成的Pd触点顶部。
由于极性变化,Pd触点和溶液中的Ag/AgCl参比电极之间的电压(VH⁺)会在Pd触点和溶液之间产生H⁺的流动,H⁺的流动会诱导PdHx的电化学形成(或溶解),从而在电子威廉希尔官方网站
中产生可测量的电流(IH⁺),研究人员使用该方法来测量由于离子通道插入和活性变化而导致的膜电导变化。
接着,为了创建仿生离子通道,使H⁺能够在脂双层上转移,研究人员通过自下而上的合理设计,用等摩尔量的13条短ssDNA链自组装成6个相互连接的螺旋束(6HB),形成了一个14 nm长的具有中空管腔的纳米桶状结构。然后,研究人员用四乙二醇-胆固醇(TEG-Chol)将DNA纳米孔功能化,为亲水性DNA纳米孔插入到脂双层的疏水环境提供锚点,进一步表征确定了纳米孔的尺寸、稳定性及孔径。
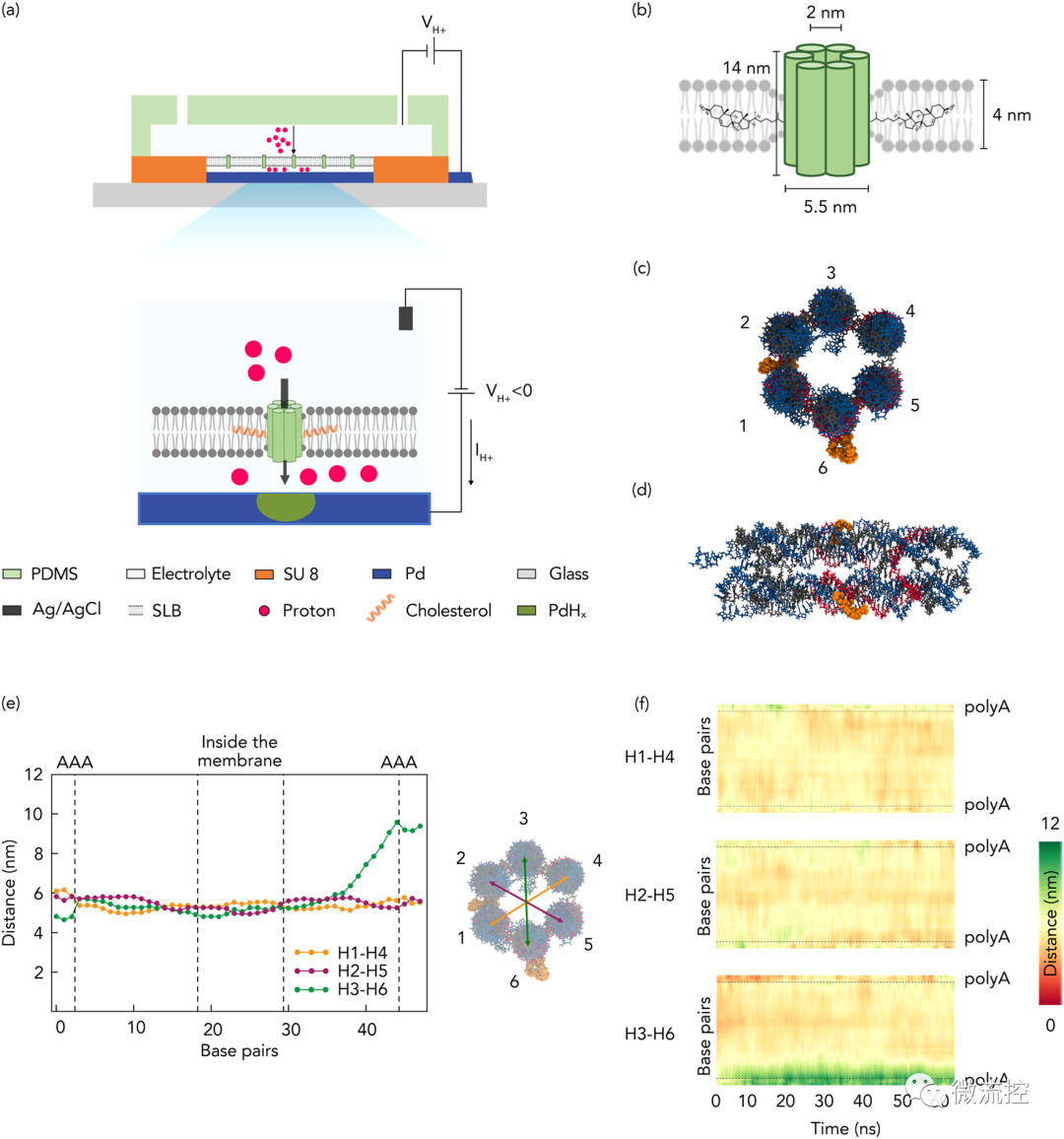
图1 生物质子器件原理图
为了验证DNA纳米孔离子通道确实是H⁺导体,研究人员测量了DNA生物电子器件中IH⁺对VH⁺的依赖性。首先,研究人员验证了裸Pd接触在溶液界面对H⁺的转移,并记录IH⁺作为VH⁺的函数,结果发现,VH⁺的变化促使了H⁺在PdHx和溶液之间的转移。
其次,研究人员证实了脂双层会产生屏障并阻止H⁺从溶液转移到Pd表面。研究人员测量了H⁺通过纳米孔的转移,测量电流表明,只有极少的H⁺穿过了双层膜并在Pd表面减少,这可能是由于表面缺陷造成的。接着,研究人员在溶液中加入两个胆固醇处理修饰的DNA纳米孔(6HB-2C)后,研究人员预计DNA纳米孔会自发插入脂质双分子层,形成跨膜离子通道,但具有一个或三个胆固醇修饰的纳米孔(6HB-1C和6HB-3C)不能插入脂双层,这主要是由于疏水性需要控制在一定范围所导致的。
如图2b所示,纳米孔的这种插入导致VH⁺= - 400 mV时的IH⁺远大于脂双层涂层,表明DNA纳米孔为H⁺在脂双层上移动提供了途径。为了避免质子在Pd接触点上的积累,在第二阶段中,研究人员将VH⁺设置为0 mV。比电解质更高的光化学势导致质子释放到电解质中并带正IH⁺。如图2b右所示,未经胆固醇处理的DNA纳米孔没有插入到脂双层中,这一点得到了裸脂双层观察到的IH⁺的证实。
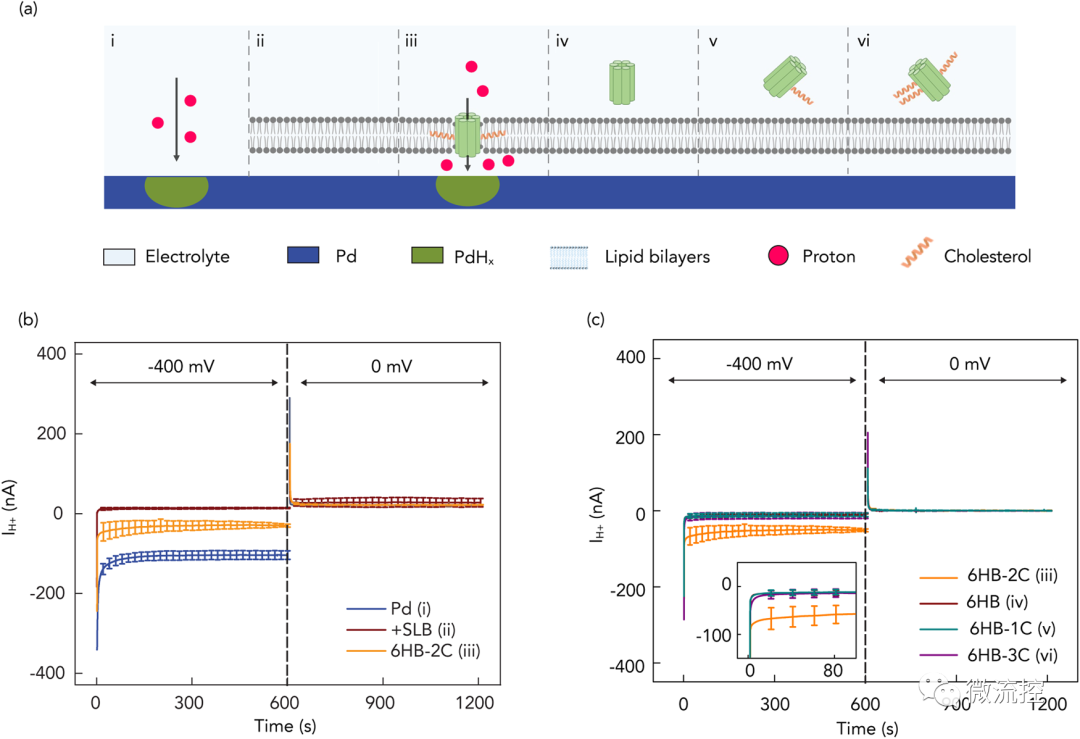
图2 膜跨越DNA纳米孔调控H⁺的示意图
随后,研究人员通过设计DNA序列编程DNA纳米孔所需的功能,分别使用体外SELEX技术选择生物素或DNA适配体(AP)处理纳米孔,用于检测两种蛋白质链亲和素(S-avidin)和心脏生物标志物B-type natriuretic peptide(BNP)。为此,研究人员在5'端分别用生物素或AP修饰ssDNA,进而功能化6HB-2C纳米孔,进行DNA杂交,以获得6HB-2C-2B和6HB-2C-2AP。正如预期的那样,插入到脂双层6HB-2C-2B纳米孔在VH⁺ = -400 mV时产生了较大的集成电流IH⁺,这表明DNA纳米孔内的纳米桶结构有助于H⁺通过脂双层运输。然而,当亲和素以5倍于纳米孔浓度的过量浓度引入环境时,亲和素与生物素在DNA纳米孔上的结合事件有效地阻塞了纳米管,阻碍了H⁺在脂双层上的运输,这可以通过IH⁺的减少来表明。
为了证实亲和素确实阻断了DNA结构周围的孔,研究人员将非生物素化的6HB-2C暴露于溶液中相同浓度的亲和素中,并在加入蛋白质前后进行了荧光成像实验,结果表明亲和素与生物素的结合确实阻断了通道并导致集合电流降低。随着亲和素浓度的增加,更多的纳米孔与亲和素相互作用,导致更多的通道堵塞,电流下降。
然后,研究人员用6HB-2C-2AP纳米孔进行了类似的实验和对照。与生物素标记的纳米孔一样,DNA适体标记的纳米孔插入脂双层中形成跨膜离子通道,并导致H⁺的运输。当BNP蛋白以5倍于纳米孔浓度的浓度被引入环境时,在VH⁺ = -400 mV时,观察到IH⁺降低。这表明AP-BNP在离子通道边缘的亲和相互作用阻断了H⁺的转运。与生物素-亲和素相比,AP-BNP的电流降低幅度较小,这是由于其相互作用的亲和力较弱。
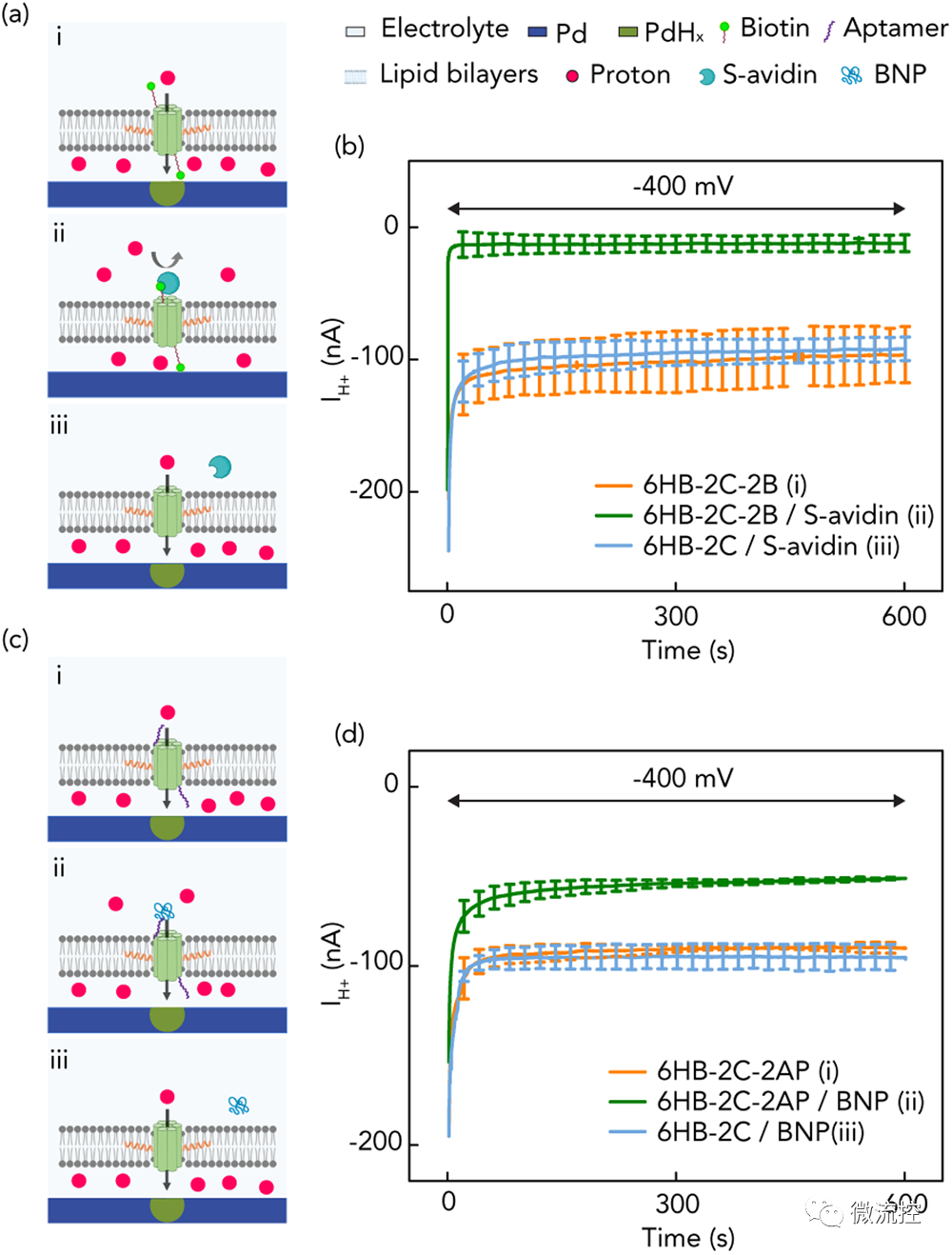
图3 生物素-链亲和素和适配体-肽的生物质子器件示意图
最后,为了更好地理解DNA纳米孔插入脂双层的动力学,研究人员建立了一个基于Langmuir方程和吸收/解吸动力学的模型来分析DNA纳米孔在脂质双分子层中的插入过程,测定了IH⁺与引入的6HB-2C浓度、纳米孔数与引入6HB-2C浓度、IH⁺与纳米孔数及IH⁺与时间的曲线。
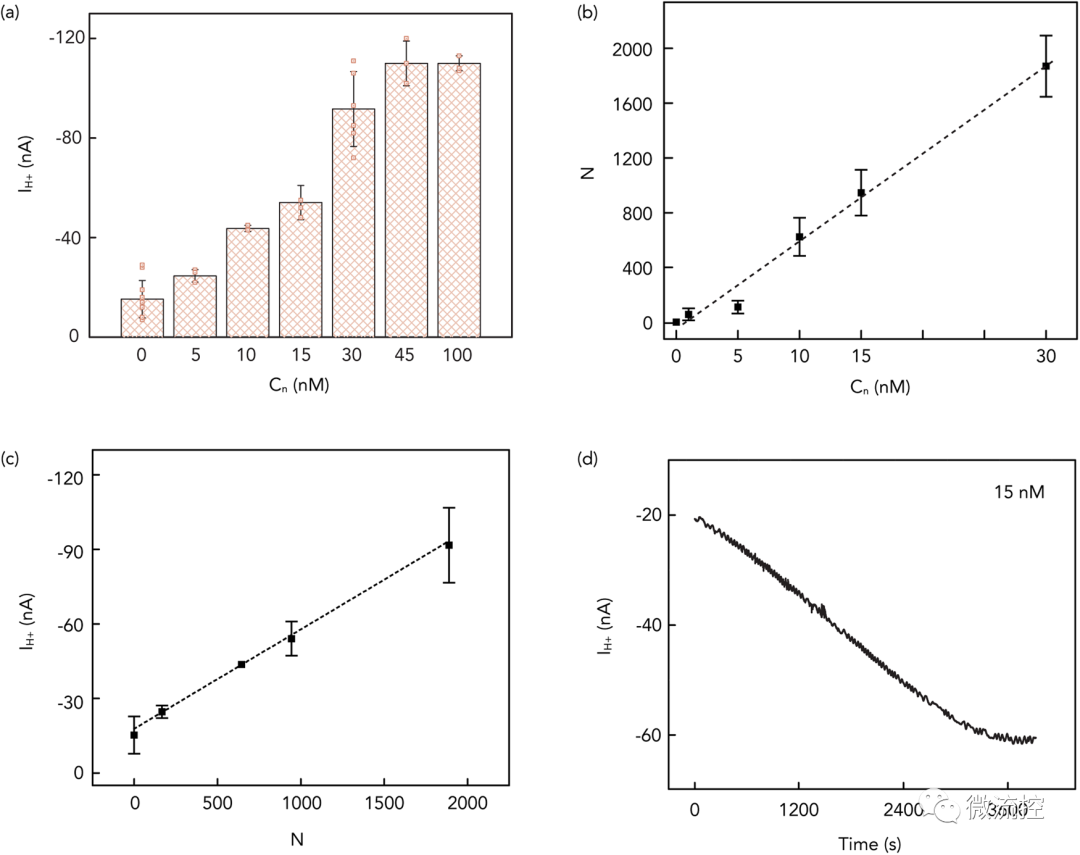
图4 DNA纳米孔表征示意图
综上所述,研究人员展示了一种可编程的生物质子器件,它具有跨膜DNA纳米孔离子通道作为分子互连通道,可以测量和控制H⁺在脂质双分子层界面上的转移。该方法的特点如下:
(1)能够利用DNA结构的可编程性来设计纳米孔并修改其表面,以电子的方式在体外感知特定的生物分子,而无需对生物分子进行额外的预处理;
(2)该方法可以同时收集来自多个通道的响应,集成方法补偿了单个通道记录中的任何变异性或异常值,从而使数据更加一致可靠;
(3)消除了与单分子器件相关的高精度设备和个性化定制的必要,简化了器件制造和信号记录过程。同时,该研究进行了集成实验,建立了动态模型,探索了这种DNA纳米孔结构在生物传感领域的潜在应用。
审核编辑:刘清
-
集成威廉希尔官方网站 制造技术的应用2009-08-20 0
-
硅基的量子器件和纳米器件2018-08-24 0
-
DNA场效应管传感器的分子设计2018-10-25 0
-
纳米技术和生物传感器的未来发展趋势如何2020-04-21 0
-
四种DNA自组装和设计纳米结构的尺寸和生产的论文方法解读2017-12-11 7507
-
DNA纳米结构的功能化及其生物学应用2018-02-11 737
-
DNA分子机器控制的金纳米粒子恒温组装2018-02-11 820
-
自组装DNA纳米材料结构与功能的研究2018-02-11 884
-
基于DNA折纸模板的金纳米颗粒自组装及其等离子体共振效应研究2018-02-11 796
-
基于DNA分子的微纳米材料的构建和应用2018-02-11 1044
-
声悬浮液滴表面的纳米颗粒自组装2019-06-04 5262
-
上海药物所提出了有机小分子智能自组装纳米微粒的解决思路2021-03-26 2772
-
集成威廉希尔官方网站 制造中的定向自组装技术2023-06-02 837
-
一种孔径小于10纳米的固态纳米孔制备新技术2023-07-04 333
-
功能化DNA水凝胶在生物传感领域的应用研究进展综述2024-04-20 1407
全部0条评论

快来发表一下你的评论吧 !

